По мере того, как использование дентальных имплантатов продолжает расти, увеличивается и частота биологических осложнений. Когда периимплантит уже привёл к выраженной резорбции кости, стоматолог сталкивается с дилеммой: какую терапию выбрать, чтобы сохранить имплантат. Поскольку методы нехирургического лечения периимплантита показали ограниченную эффективность, в данной статье описываются различные хирургические подходы с акцентом на их показания и ограничения.
Основная цель лечения периимплантита — деконтаминация поверхности инфицированного имплантата и устранение глубоких периимплантатных карманов. С этой целью эффективно применяется подход с формированием лоскутов с резекционными процедурами или без них. Однако такие хирургические методы могут сопровождаться послеоперационной рецессией слизистой. Помимо купирования воспаления, реконструктивные методики направлены также на регенерацию костного дефекта и восстановление остеоинтеграции.
Показания к хирургическому лечению периимплантита
Эффективное лечение периимплантита направлено на деконтаминацию инфицированной поверхности имплантата и уменьшение глубины зондирования до 5 мм и менее. Для достижения этой цели предложены различные стратегии, заимствованные из пародонтальной терапии, включающие как неоперационные, так и хирургические вмешательства.
Несмотря на многочисленные попытки лечить периимплантит неоперационными методами, такими как механическая обработка или закрытые подходы без формирования лоскута, часто в сочетании с дополнительными средствами (антибиотики, лазерная терапия) клиницисты наблюдали лишь ограниченные улучшения клинических показателей, таких как уменьшение глубины зондирования и кровоточивость при зондировании. Основная трудность заключается в обеспечении адекватного доступа к поверхности имплантата для тщательной деконтаминации и удаления биоплёнки, особенно в случаях с глубокими карманами и сложной геометрией поверхности имплантата.
В соответствии с клиническими рекомендациями Европейской федерации пародонтологии, неоперационные протоколы следует использовать для стабилизации состояния мягких тканей вокруг имплантата до перехода к хирургическому лечению. Проведение хирургического вмешательства требует тщательной оценки факторов, связанных как с пациентом, так и с имплантатом, которые могут влиять на раннее заживление и долгосрочные результаты.
Хирургическая процедура, как правило, включает формирование полнослойного слизисто-надкостничного лоскута для доступа к инфицированной поверхности имплантата, последующее удаление грануляционной ткани и тщательную деконтаминацию периимплантатной поверхности. Для максимального удаления биоплёнки при сохранении целостности титановой поверхности на протяжении лет предлагались различные ручные и механические инструменты. Однако ни одно из устройств не показало явного преимущества в эффективности деконтаминации.
Недавние достижения включают разработку нового электролитического устройства для очистки, при котором на корпус имплантата подаётся напряжение, а на его поверхность подаётся раствор формиата натрия. Несмотря на обнадёживающие доклинические и краткосрочные клинические результаты, регулярное использование данного метода пока не рекомендуется.
Согласно имеющимся данным, перед оценкой формы костного дефекта рекомендуется комбинированный подход, сочетающий механическую и химическую деконтаминацию. С клинической точки зрения выделяют две основные хирургические методики лечения:
- a. лоскутный доступ, который может сочетаться с резекционными техниками или имплантопластикой;
- b. реконструктивные операции, направленные на восстановление утраченной периимплантатной кости с использованием костных заменителей.
Лоскутный доступ без резекционных процедур
Лоскутный доступ для обработки поверхности имплантата (Access Flap Debridement, AFD) включает формирование слизисто-надкостничного лоскута с последующим удалением воспалительной ткани для обеспечения доступа к контаминированной поверхности имплантата. После удаления грануляционной ткани поверхность имплантата подвергается деконтаминации с применением механических, химических и, при необходимости, дополнительных методов, таких как фотодинамическая терапия или лазерная обработка. Затем лоскут репозиционируют и фиксируют швами.
Исследования подтвердили эффективность такой «открытой» обработки без резекционных процедур: отмечены хорошие показатели выживаемости имплантатов и умеренные успехи лечения (например, глубина кармана 5 мм и менее, отсутствие кровоточивости или гноетечения при зондировании, отсутствие прогрессирующей потери кости) в течение до пяти лет наблюдения. Однако, несмотря на начальные положительные результаты, поддержание долгосрочной стабильности остаётся проблемой. По данным исследований, стойкое разрешение заболевания после AFD, даже при сочетании с системной антимикробной терапией, наблюдалось только у 53% имплантатов и 63% пациентов.
Лоскутный доступ с резекционными процедурами
В пятилетнем исследовании, посвящённом анализу резекционного подхода с контурированием кости и системной антимикробной терапией, у 54% имплантатов были достигнуты успешные результаты, определяемые как разрешение заболевания. Однако у 44% имплантатов наблюдалось рецидивирование или прогрессирование заболевания, что привело к удалению 27 имплантатов. Было отмечено статистически значимое влияние остаточной глубины периимплантатного кармана ≥6 мм через год после лечения на снижение уровня маргинальной кости, что указывает на более высокий риск рецидива или прогрессирования периимплантита. Кроме того, имплантаты с модифицированной поверхностью имели больший риск прогрессирования заболевания по сравнению с имплантатами с немодифицированной поверхностью.
Долгосрочное ретроспективное когортное исследование продолжительностью до 11 лет показало благоприятные клинические и рентгенологические результаты после AFD в сочетании с реконтурурованием кости. Было подчёркнуто влияние типа поверхности имплантата: имплантаты с гладкой (turned) поверхностью демонстрировали лучшие результаты по сравнению с модифицированными шероховатыми поверхностями.
Влияние характеристик поверхности имплантата на выживаемость и успешность лечения периимплантита после хирургического вмешательства отмечалось и другими авторами. При использовании костного материала — депротеинизированного бычьего костного минерала (DBBM) с 10% коллагена — наблюдались различные показатели выживаемости: имплантаты с пескоструйно и кислотно-протравленой поверхностью демонстрировали выживаемость около 80%, тогда как имплантаты с титановым плазменным напылением — около 55% при наблюдении в течение 7–10 лет.
Имплантопластика включает сглаживание супракрестальных витков и оголённых шероховатых поверхностей имплантата для облегчения удаления биоплёнки и снижения её адгезии в фазе поддерживающего лечения. Однако современные данные о преимуществах имплантопластики по сравнению с другими методами деконтаминации при хирургическом лечении периимплантита остаются противоречивыми.
Сравнительные исследования оценивали эффективность имплантопластики по сравнению с альтернативной деконтаминацией при помощи воздушно-полировочной обработки глициновым порошком. Клинические оценки через три и шесть месяцев показали сопоставимые результаты по глубине зондирования и кровоточивости при зондировании, что говорит о сходной эффективности обеих методик.
Тем не менее, существуют опасения, связанные с имплантопластикой, включая возможность попадания частиц титана в периимплантатные мягкие ткани и риск перелома имплантата, что требует дальнейших исследований. Следует проявлять осторожность при выполнении имплантопластики у имплантатов малого диаметра, которые могут стать более подверженными перелому.
С клинической точки зрения важно учитывать возможность увеличения послеоперационной рецессии средней пришеечной зоны слизистой по вестибулярной поверхности после имплантопластики по сравнению с лоскутными или реконструктивными вмешательствами, особенно в случаях, когда эстетика имеет значение.
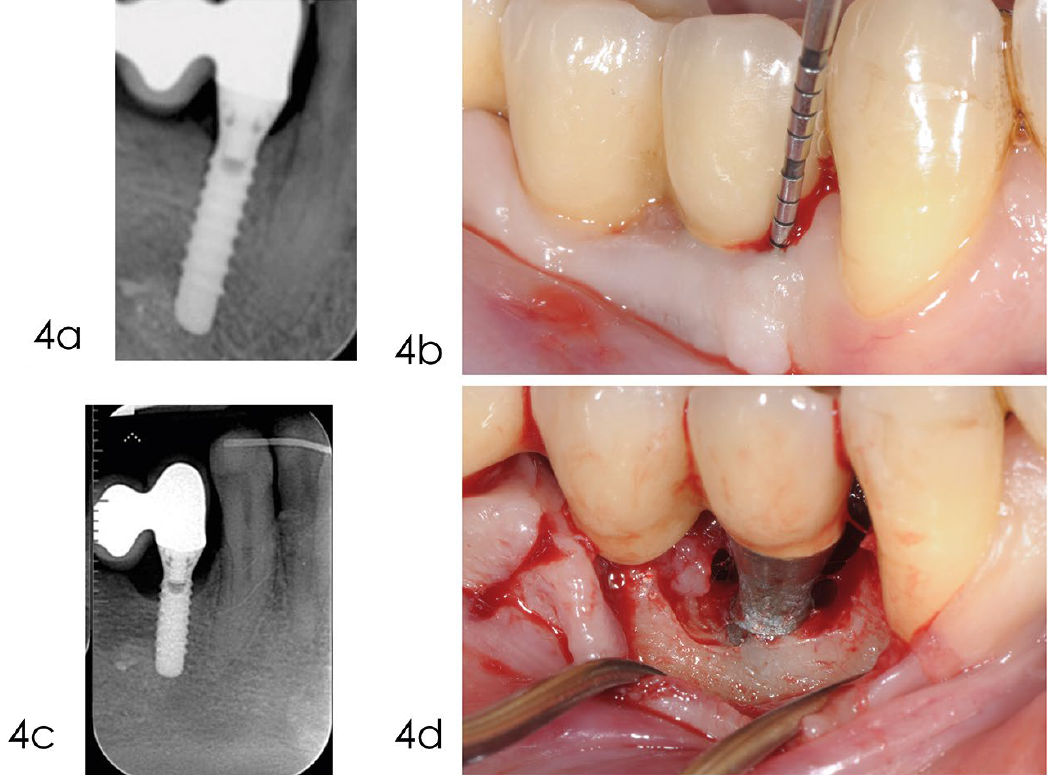
Фото 4. Обработка с доступом через лоскут
a) Рентгенограмма, выполненная через год после установки протеза, показывает оптимальный уровень кости вокруг имплантата. b) Кровоточивость при лёгком зондировании и глубина кармана 6 мм через пять лет после установки имплантата. c) Рентгенограмма, выполненная в декабре 2014 года, показывает краевую убыль кости в области имплантата 4.4. d) При отслаивании полнослойного лоскута выявлена убыль кости на уровне второго витка. Из-за тонкого костного гребня без внутриостного компонента было принято решение отказаться от реконструктивного подхода в пользу открытой инструментальной обработки
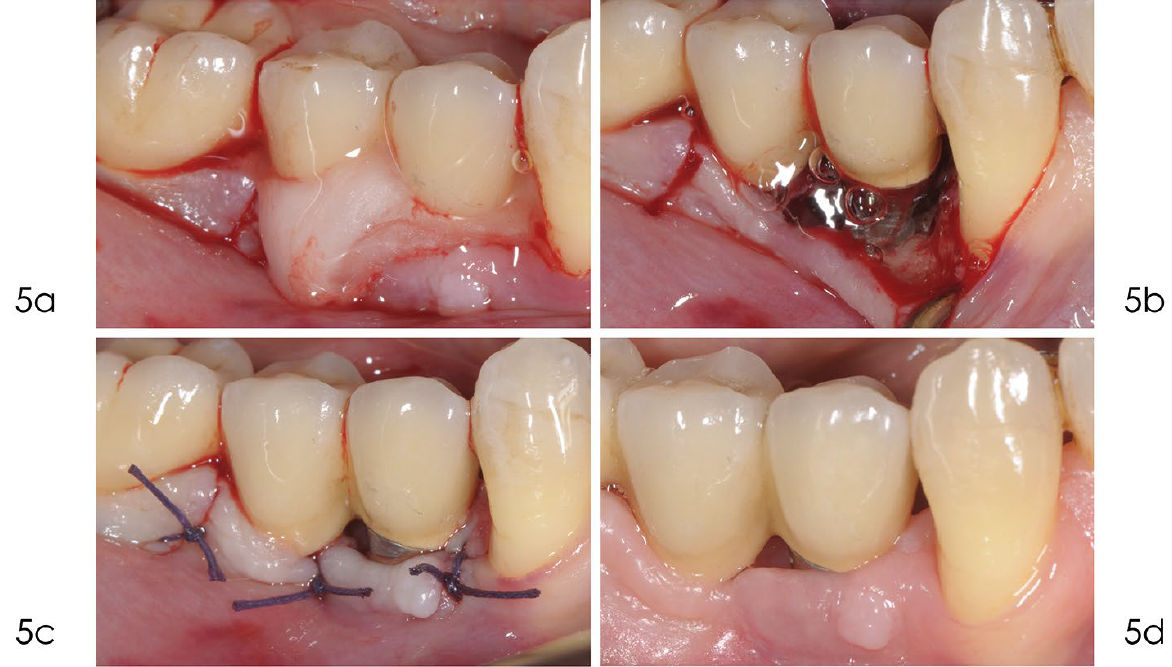
Фото 5. a) После удаления грануляционной ткани поверхность имплантата была обработана 24% ЭДТА в течение двух минут. b) После промывания физиологическим раствором на поверхность нанесён гель хлоргексидина 1% на две минуты. c) Шов нитью Vicryl 4/0 обеспечивает оптимальное открытое (непогружённое) заживление. d) Заживление проходит без осложнений
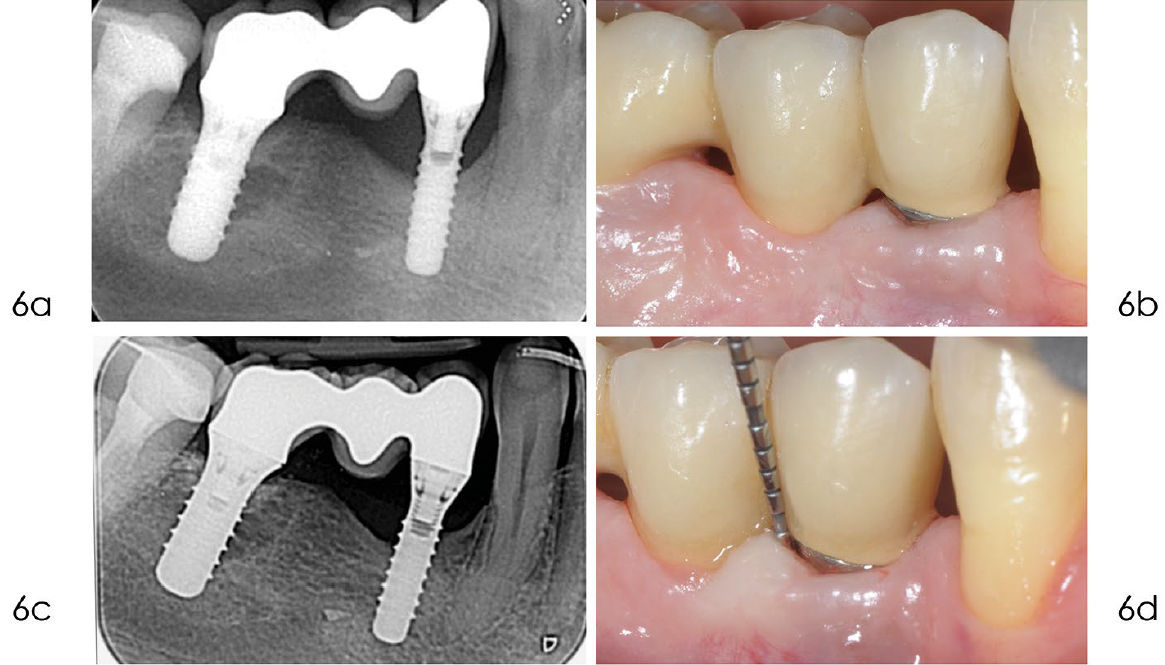
Фото 6. a) Рентгенограмма, выполненная в сентябре 2020 года, через десять лет после установки имплантата, показывает стабильный костный дефект. b) Клиническое изображение, сделанное в сентябре 2020 года, демонстрирует отсутствие воспаления в мягких тканях вокруг имплантата. c) Рентгенограмма, выполненная в январе 2024 года, подтверждает отсутствие дальнейшей потери кости дистально и небольшое улучшение с мезиальной стороны. d) Клиническое изображение, сделанное в январе 2024 года, показывает минимальную рецессию мягких тканей через 14 лет после установки имплантата. Зондирование выявляет стабильную, хотя и не идеальную, глубину пародонтального кармана
Показания и эффективность реконструктивных подходов
После удаления грануляционной ткани и деконтаминации поверхности имплантата хирургическая реконструкция является предпочтительной, поскольку позволяет восстановить анатомию утраченных тканей, достичь реостеоинтеграции и ограничить рецессию периимплантатных мягких тканей. Систематические обзоры, посвящённые результатам таких реконструктивных процедур, представили неоднозначные данные. Разнообразие результатов, вероятно, связано с неоднородностью исследований, различиями в степени тяжести заболевания и применяемых хирургических техниках.
Консенсусный отчёт 15-го Европейского семинара по пародонтологии, посвящённый костной регенерации, определил, какие факторы, связанные с пациентом и с участком вмешательства, необходимо учитывать при выборе реконструктивных методик в хирургическом лечении периимплантита.
При планировании реконструктивного лечения врачу следует убедиться, что соблюдены следующие пациент-ассоциированные условия:
- Готовность пациента к вмешательству и участию в индивидуальной программе поддерживающего ухода.
- Реалистичные ожидания пациента.
- Низкие показатели зубного налёта по всей полости рта (менее 20%).
- Низкие показатели кровоточивости по всей полости рта (менее 20%).
- Курение менее 10 сигарет в день.
- Отсутствие медицинских противопоказаний к хирургическому вмешательству.
Кроме того, врач должен учитывать факторы, связанные с участком имплантата:
- Глубина внутрикостного дефекта более 3 мм.
- Конфигурация дефекта: предпочтительно ограниченный дефект с тремя или четырьмя стенками.
- Наличие зоны кератинизированной периимплантатной слизистой.
Однако большинство опубликованных исследований не учитывали все эти факторы, что создаёт неопределённость у клиницистов относительно показаний и выбора реконструктивных подходов.
Главной целью семинара было суммировать доказательные рекомендации по индивидуальным вмешательствам при лечении заболеваний периимплантатной зоны, основанные на лучших доступных данных и/или экспертном консенсусе. Для оценки эффективности костных реконструктивных методов в лечении периимплантатных дефектов был проведён систематический обзор под руководством профессора Доноса и соавторов. По результатам метаанализа сделан вывод, что как лоскутные, так и реконструктивные операции могут значительно улучшать клинические показатели периимплантата через 12 месяцев наблюдения, при этом реконструктивные методы обеспечивают лучшие рентгенологические результаты. Таким образом, поскольку реконструктивная хирургия не даёт значительных клинических преимуществ по сравнению с доступными лоскутными методиками, врач может предпочесть менее сложный вариант — лоскутную операцию.
Тем не менее, в обзор были включены различные реконструктивные методы: использование амелогенина; применение костного заменителя DBBM с 10% коллагена, как самостоятельно, так и с коллагеновой мембраной; титановые гранулы; а также β-трикальцийфосфат с пролонгированным высвобождением местного доксициклина. Метаанализ охватывал лишь те исследования, где применялись костные трансплантаты с мембраной или без неё, в то время как исследования, использующие титановые гранулы или биологически активные факторы, не были включены.
Кроме того, не удалось установить иерархию эффективности между различными материалами, используемыми для реконструктивной хирургии. Это не означает, что современные костные заменители неэффективны: в частности, DBBM с 10% коллагена в последние годы получил широкое признание среди исследователей. Некоторые работы, однако, сообщают, что использование барьерной мембраны может повышать риск ранних осложнений, главным образом, расхождения мягких тканей и экспозиции мембраны или трансплантата.
В рамках данного обзора не рассматривалось влияние дизайна лоскута и особенностей хирургического ведения на результаты лечения, хотя эти факторы могут иметь решающее значение при выборе реконструктивной методики. Следует подчеркнуть, что реконструктивное лечение периимплантатных дефектов — это гораздо больше, чем просто добавление костного трансплантата при доступе к имплантату, как это нередко трактуется в клинических исследованиях.
Учитывая эти ограничения, в настоящее время не существует убедительно доказанного, основанного на данных подхода к реконструктивной хирургии при дефектах, связанных с периимплантитом. Клиническое ведение таких случаев обычно основывается на «мнениях экспертов» и опирается на опыт регенеративного лечения пародонтальных дефектов. Основная цель подобных хирургических методик — минимизация послеоперационной рецессии мягких тканей.
Для регенеративного лечения пародонтальных дефектов было разработано несколько хирургических техник, направленных на оптимизацию первичного закрытия раны и снижение хирургической травмы при лечении внутриостных дефектов. Основной принцип заключается в формировании одного лоскута (т.е. только с вестибулярной или нёбной/ язычной стороны, в зависимости от направления основного распространения дефекта) для обеспечения доступа к дефекту, при этом хотя бы один межзубной сосочек должен оставаться интактным.
Другим важным аспектом является формирование раннего и долговременного эффективного барьера вокруг шейки имплантата, который способен биологически защищать периимплантатные структуры.
При отсутствии четких, основанных на доказательствах хирургических рекомендаций следует учитывать несколько общих принципов реконструктивной терапии дефектов при периимплантите:
- Глубокие и узкие дефекты более благоприятны для стабилизации костного графта и последующего образования новой кости.
- Объем и протяженность полнослойного лоскута должны тщательно планироваться, чтобы сбалансировать минимальную инвазивность процедуры с необходимостью обеспечить доступ ко дну дефекта.
- Регенеративный биоматериал следует подбирать на основании научной валидации и наносить без избыточного переполнения дефекта.
- Костный заменитель следует вводить только после полного удаления грануляционной ткани и тщательной деконтаминации поверхности имплантата.
- В случаях недостаточной ширины зоны кератинизированной слизистой следует подготовить и адаптировать соединительнотканный трансплантат так, чтобы он перекрывал весь дефект и распространялся на 2–3 мм окружающей альвеолярной кости для обеспечения стабильности трансплантата. Если дефект циркулярный и расположен в области без кератинизированной слизистой, возможно использование крупного соединительнотканного трансплантата и его адаптация по периметру дефекта.
- Пациента необходимо проинструктировать о том, как защищать, ухаживать и содержать в чистоте операционную область, чтобы способствовать первичному заживлению раны.
Исходя из этих принципов, можно с уверенностью утверждать, что внутрикостные дефекты при периимплантите вокруг правильно установленных имплантатов могут быть успешно вылечены реконструктивной хирургией в большом проценте случаев.
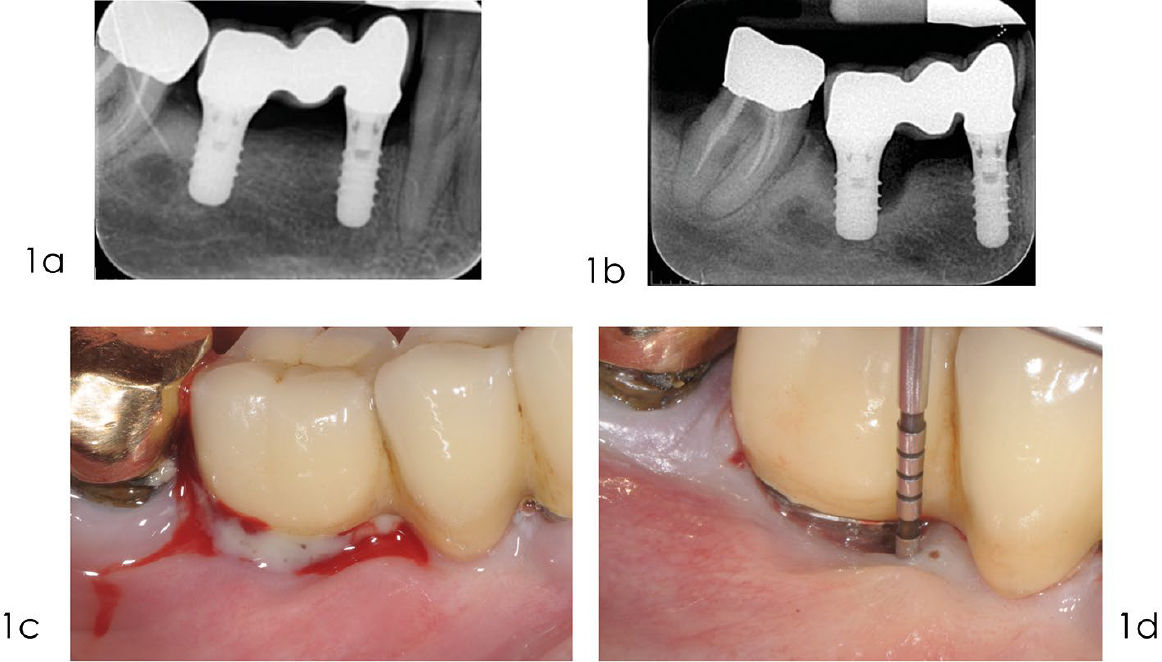
Фото 1. Реконструктивное лечение периимплантита: диагностика
a) Рентгенограмма, выполненная в сентябре 2010 года, через три года после установки протеза, показывает оптимальный уровень кости вокруг имплантата. b) Рентгенограмма, выполненная в декабре 2014 года, демонстрирует выраженную краевую убыль кости в области имплантата 4.6. c) Кровоточивость при лёгком зондировании и/ или наличие гноя — основные клинические признаки мукозита и периимплантита. d) Участки с периимплантитом характеризуются клиническими признаками воспаления, увеличенной глубиной зондирования, а также рентгенологической убылью кости по сравнению с предыдущими обследованиями. Существует определённая связь между периимплантитом и отсутствием кератинизированной слизистой
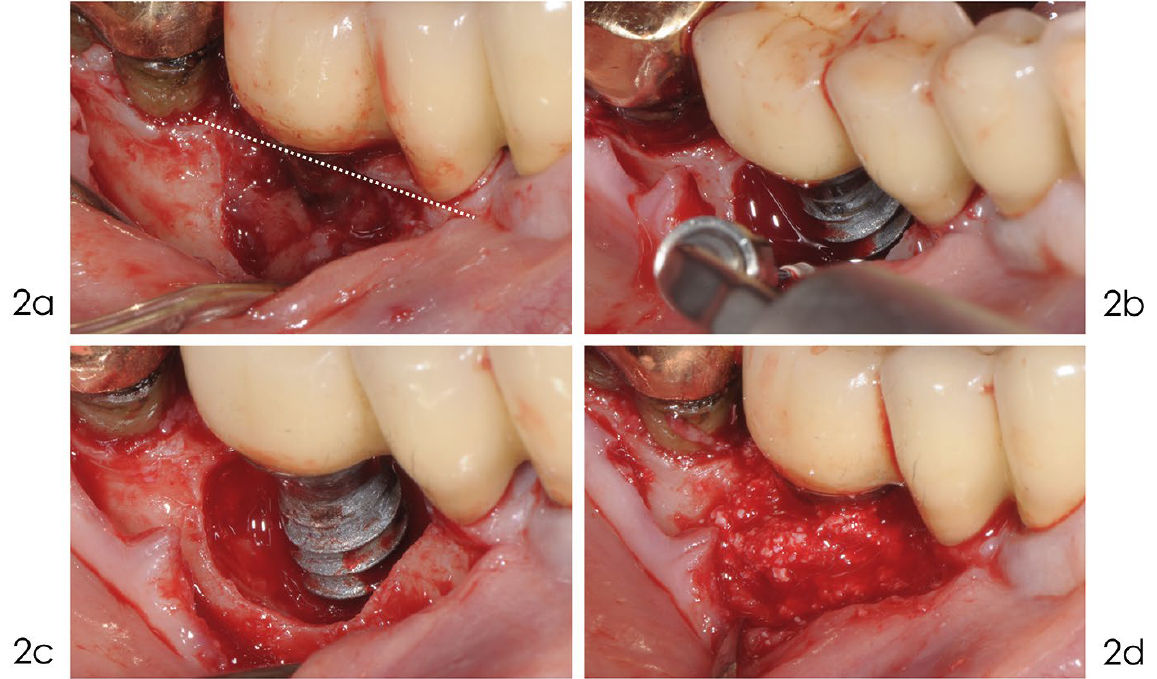
Фото 2a-d. Реконструктивное лечение периимплантита
a) Выполнен линейный разрез по гребню альвеолярного отростка с сохранением мезиального сосочка для облегчения стабилизации лоскута над областью трансплантата. b) Открытая поверхность имплантата была тщательно очищена с помощью ультразвука с тефлоновой насадкой под постоянным орошением физиологическим раствором. c) После удаления грануляционной ткани поверхность имплантата была деконтаминирована 24% раствором ЭДТА и гелем хлоргексидина 1%. d) Внутрикостный дефект заполнен деминерализованным костным материалом крупного рогатого скота с 10% коллагена
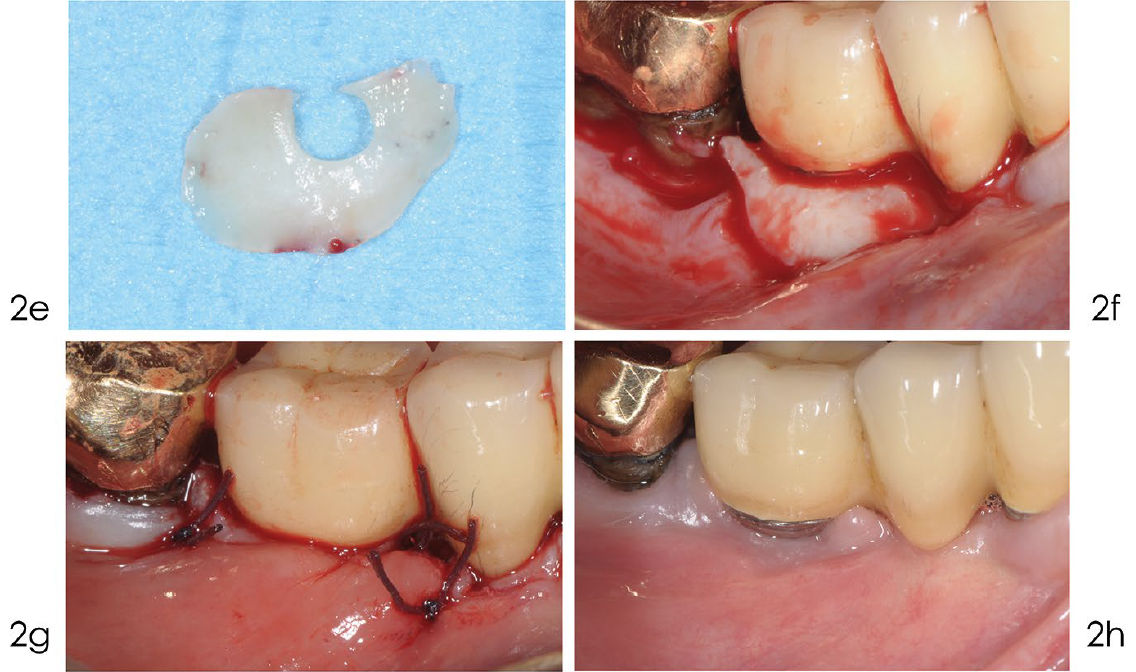
Фото 2e-h. Реконструктивное лечение периимплантита
e) Соединительнотканный трансплантат взят из бугра верхней челюсти и имеет U-образную форму. f) Трансплантат адаптирован вокруг шейки имплантата и полностью закрывает дефект для обеспечения стабильности материала. g) Шов нитью Vicryl 4/0 обеспечивает оптимальное открытое (непогружённое) заживление. h) Оптимальное заживление через год: отсутствуют признаки воспаления, вокруг имплантата сформировалась зона кератинизированной слизистой
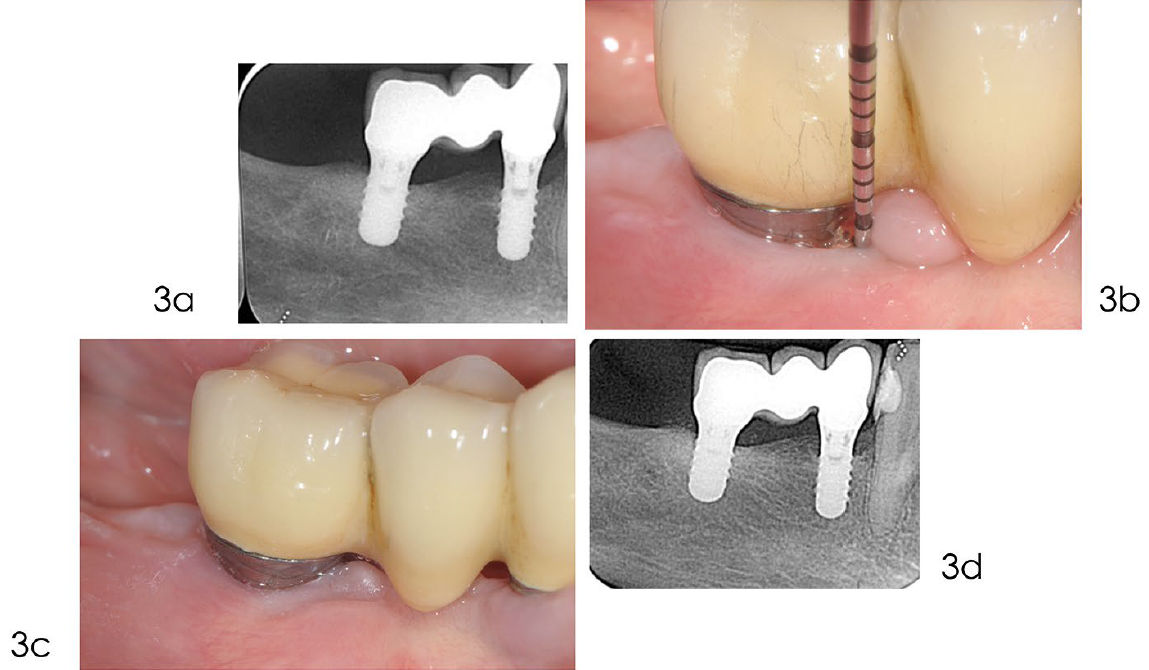
Фото 3. Динамическое наблюдение (поддерживающая терапия)
a) Рентгенограмма, выполненная в мае 2019 года, демонстрирует полное заполнение дефекта костью. b) После хирургического лечения пациенту была назначена индивидуализированная программа поддерживающего ухода, включающая гигиену полости рта, удаление биоплёнки и контроль факторов риска. c) Клиническое изображение от ноября 2021 года показывает здоровые ткани вокруг имплантата. Зондирование выявляет неглубокие карманы и отсутствие кровоточивости. d) Рентгенограмма, выполненная в марте 2023 года, через 16 лет после установки имплантата, демонстрирует оптимальный уровень межзубной кости
Заключение
Основная цель лечения периимплантита — устранить инфекцию и остановить прогрессирующую потерю кости вокруг имплантата. В отличие от пародонтита, нехирургическое лечение, как правило, недостаточно эффективно при периимплантите, особенно в запущенных случаях с глубокими костными дефектами. Тем не менее, нехирургический этап обычно является первым шагом лечения, поскольку он создаёт более благоприятные условия вокруг имплантата перед хирургическим вмешательством.
Независимо от выбранного хирургического подхода, адекватный контроль налёта является ключевым фактором успешного результата. Хирургия с доступом через лоскут может сопровождаться послеоперационной рецессией слизистой и образованием мягкотканных дефектов, что может вызывать эстетические проблемы.
Реконструктивные методики направлены на восстановление оптимальных условий для твёрдых и мягких тканей, что способствует их долгосрочному сохранению и поддержанию эстетики.
Реконструктивное лечение периимплантита включает специальные дизайны лоскутов, целью которых является минимизация хирургической травмы, сохранение межзубных тканей и уровня краевой слизистой вокруг имплантата.
Дизайн лоскута может играть ключевую роль в повышении эффективности реконструктивной терапии дефектов периимплантита и должен определяться конфигурацией дефекта (его формой, числом стенок, глубиной), его тяжестью, типом и положением имплантата, а также особенностями периимплантатных мягких тканей. Все эти факторы затрудняют проведение рандомизированных контролируемых исследований.
Применение минимально инвазивного подхода следует поощрять, чтобы снизить травматичность вмешательства, при этом необходимо сохранять возможность адекватного доступа ко всему костному дефекту.
По материалам Mario Roccuzzo et al., «Surgical treatment of peri-implantitis», 2024
