Богатая тромбоцитами плазма и другие производные крови широко используются в различных областях медицины и тканевой инженерии. Они представляют собой натуральные коктейли аутологичных факторов роста, которые могут обеспечить альтернативу рекомбинантным белковым составом. Такие производные крови последовательно демонстрируют потенцирование пролиферации, миграции и дифференцировки стволовых клеток. Здесь мы рассмотрим спектр богатых тромбоцитами кровяных производных, обсудим их современное применение в тканевой инженерии и регенеративной медицине, рассмотрим их влияние на стволовые клетки и выделим текущие проблемы применения.
Введение
Богатая тромбоцитами плазма рассматривается как очень перспективное направление в регенеративной медицине. Тканевая инженерия традиционно стимулирует клетки, используя один биоактивный агент с ключевыми регенеративными функциями. Однако, естественная регенерация тканей основана на коктейле сигнальных молекул и факторов роста. Во время естественного заживления ран активированные тромбоциты концентрируются в области раны и выделяют множество факторов, которые играют важную роль в координации заживления ран.
Использование одного фактора роста для управления регенерацией тканей представляет собой слишком упрощенное и неэффективное воздействие. Это, как правило, решается путем предоставления супрафизиологических количеств фактора роста. Вследствие этого в быстро растущем числе исследований изучалась эффективность подходов к тканевой инженерии на основе стволовых клеток с естественным коктейлем из факторов роста, например концентратом тромбоцитов. Это открыло путь для улучшения функции стволовых клеток, включая их рост, жизнеспособность, пролиферацию, дифференцировку и общий регенеративный потенциал. Таким образом, концентраты тромбоцитов широко используются в медицине. Более того, их использование подкрепляется их доступностью, экономичностью, широким спектром приложений и аутологичным характером. Действительно, было сообщено о нескольких клинических применениях концентратов тромбоцитов в областях дерматологии, ортопедии, стоматологии и офтальмологии.
Богатая тромбоцитами плазма
Активация тромбоцитов вызывает дегрануляцию и последующее выделение трофических факторов, влияющих на заживление ран, восстановление тканей, ангиогенез и поведение стволовых клеток. Внутри тромбоцитов присутствуют два типа гранул: альфа гранулы и плотные гранулы. Альфа-гранулы влияют на заживление ран с помощью нескольких типов факторов роста, включая: фактор роста тромбоцитов (ФРТ), эпителиальный фактор роста (ЭФР), фактор роста эндотелия сосудов (ФРЭС), фактор роста эндотелиальных клеток (ФРЭК), фактор роста фибробластов (ФРФ), трансформирующий фактор роста-бета (ТФР-β) и инсулиноподобный фактор роста (ИФР).
В целом, эти факторы хемотаксически привлекают и активируют стволовые клетки, а также вызывают их митогенез и дифференцировку.
Напротив, плотные гранулы способствуют регенерации тканей путем секреции медиаторов, таких как серотонин и гистамин, которые повышают проницаемость сосудов и перфузию тканей. За прошедшие годы было изучено несколько препаратов с производными крови, богатыми тромбоцитами. Прежде всего, они получили значительное внимание в исследованиях регенерации тканей, направленных на заживление поврежденных мягких и твердых тканей.
Обогащенная тромбоцитами плазма крови
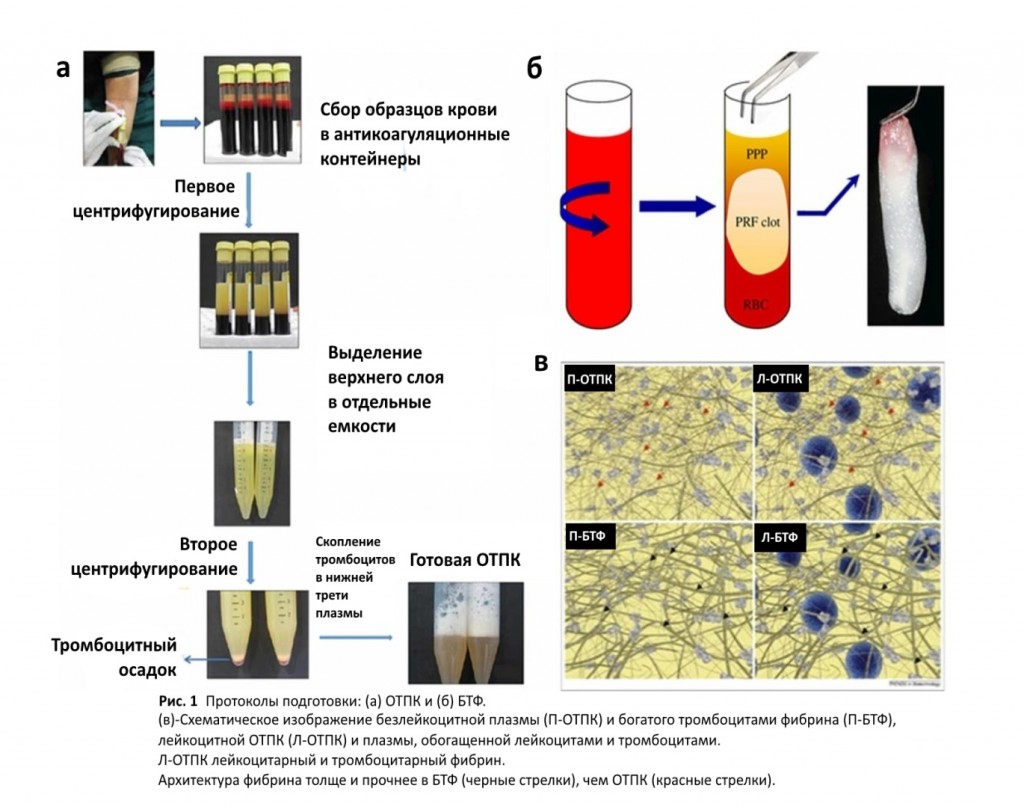
Богатая тромбоцитами плазма (обогащенная ОТПК) была введена несколько десятилетий назад. ОТПК получают посредством двухступенчатой подготовки образца крови к центрифугированию, который отверждают антикоагулянтом. На первом этапе центрифугирования выделяют три слоя: плазма сверху, эритроциты на дне, и средний слой, который содержит тромбоциты и лейкоциты. После отбрасывания эритроцитов остаток центрифугируют во второй раз, чтобы обеспечить правильное разделение плазмы. В дальнейшем ОТПК получают путем отбрасывания плазмы (Рис.1а). Этот процесс концентрирует тромбоциты приблизительно в 4-5 раз по сравнению с необработанной цельной кровью.
Изменяя протокол разделения, можно получать различные смеси. Например, различные установки центрифугирования (скорость, время) могут изменять концентрацию тромбоцитов. В одном из таких подходов, Amabel и др. исследовали, как центробежные и температурные параметры влияют на конечный продукт. Исчезновение эритроцитов и лейкоцитов с минимальной потерей тромбоцитов считалось превосходным результатом. Наиболее оптимальные результаты были получены при центрифугировании 300г в течение 5 мин при 12 ° C или 240г в течение 8 минут при 16 ° C для первого спина и 700г в течение 17 минут при 12 ° C для второго спина. В общем, более длинные центробежные периоды слегка увеличивали выход тромбоцитов и уменьшали концентрации лейкоцитов в верхнем слое. Таким образом, параметры центрифугирования могут использоваться для контроля количества лейкоцитов в ОТПК. Температура оказалась необходимой для контроля активации тромбоцитов; Низкие температуры замедляют активацию тромбоцитов и продлевают их жизнеспособность. Несмотря на свои преимущества, подготовка ОТПК основана на нескольких кустарных этапах обработки. Это приводит к относительно высокой изменчивости от партии к партии. Можно предположить, что отсутствие стандартизации может объяснить некоторые противоречивые клинические результаты.
Богатый тромбоцитами фибрин
Было предпринято несколько попыток разработать новые, простые в использовании продукты, полученные на основе тромбоцитов. Это привело к образованию богатого тромбоцитами фибрина (БТФ), который представляет собой одноступенчатый центрифугированный продукт, который не требует добавления различных химических веществ.
В частности, кровь после забора центрифугируется для предотвращения коагуляции. Впоследствии средний слой отделяется от двух других слоев (Рис.1б). Центрифугирование обычно проводят при 700г в течение 12 мин для получения стандартного БТФ (С-БТФ) или при 200г в течение 14 минут для получения активированного БТФ (A-БТФ). Ghanaati и др. сообщили, что скорость и время не влияют на концентрацию моноцитов и стволовых клеток, но влияют на таковые у тромбоцитов и нейтрофилов. В результате, A-БТФ содержит больше тромбоцитов, большинство из которых обнаруживается в дистальном слое БТФ, а С-БТФ содержит больше нейтрофилов. Этот тип белой крови обладает потенциалом для усиления ангиогенеза путем экспрессии ферментного матрикса металлопротеиназы №9. Таким образом, включение нейтрофилов в БТФ можно рассматривать, если ангиогенез представляет интерес.
БТФ может высвобождать большое количество факторов роста, включая ТФР-β1, ФРТ и ФРЭС. Основное различие между БТФ и ОТПК заключается в их фибриновых архитектурах. В БТФ эта сеть постепенно накапливается во время центрифугирования и при отсутствии антикоагулянтов. Это приводит к плотной структуре фибрина и в БТФ она действует как сеть, в которой тромбоциты и лейкоциты захватываются во время центрифугирования. Это коллекторное свойство фибриновой сети усиливает постепенное высвобождение факторов роста и других медиаторов, что приводит к длительному поддержанию и стимуляции стволовых клеток с помощью БТФ. Действительно, признаки высвобождения факторов роста, таких как ТФРβ и ФРТ, различаются у ОТПК и БТФ. В ОТПК высвобождение ТФРβ и ФРТ явно снижалось после первого дня, в то время как БТФ демонстрировал высвобождение значительных количеств ТФРβ и ФРТ в течение до 2 недель. Ehrenfest и др. подтвердили это различие в профилях высвобождения лейкоцитарного ФРЭС в БТФ по сравнению с ОТПК. Вместе эти исследования показали, что мембраны БТФ могли высвобождать большее количество факторов роста в течение длительного периода времени.
В дополнение к стандартным препаратам БТФ можно также получить форму для инъекций (И-БТФ) путем сжатия БТФ-мембран между металлическими листами. Преимущественно этот инъецируемый материал может коагулировать сразу после инъекции с образованием биоматериала, а также быть объединен с любым биоматериалом по выбору для нековалентного включения.
Богатая тромбоцитами плазма и плазма богатая фибрином в классификации производных крови. Роль лейкоцитов.
Помимо тромбоцитов, лейкоциты вносят вклад в химический состав ОТПК и БТФ секреторными молекулами, такими как интерлейкин 1β (ИЛ1β), ИЛ4, ИЛ6 и фактор некроза опухолей α (ФНОα), которые влияют на воспаление раны, васкуляризацию и регенерацию. В результате ОТПК и БТФ были разделены на две основные группы, основанные на том, содержат ли они лейкоциты или нет. Хотя лейкоциты присутствуют в традиционных ОТПК и БТФ (названных Л-ОТПК и Л-БТФ), плазмаферез этих ОТК приводят к «чистым» безлейкоцитным ОТПК и БТФ (П-ОТПК и П-БТФ). Поскольку воспаление является одной из основных стадий заживления раны, лейкоциты можно рассматривать как интересный источник клеток для инициирования и регуляции каскада регенерации тканей. Кроме того, они могут контролировать избыточное воспаление путем своевременного высвобождения противовоспалительных цитокинов, таких как ИЛ-4, ИЛ-10 и ИЛ-13. Действительно, лейкоциты обеспечивают иммунную регуляторную роль и высвобождение больших количеств ФРЭС и других цитокинов. Независимо от этого, чаще всего используемые производные крови, богатые тромбоцитами, опираются на ограниченные препараты лейкоцитов (Л-ОТПК и Л-БТФ).
Высвобождение и активность факторов роста
В дополнение к составу ОТПК и БТФ, их метод доставки играет ключевую роль в их способности влиять на стволовые клетки, а также на их клинический исход. Гидрогелевая система, использующая альгинатные носители для выделения фактора роста ОТПК, показала, что гранулы или капсулы имели различные профили высвобождения ФРТ, ТФР-β1 и ИФР-1. Альгинатные шарики показали более высокое высвобождение ТФР-β1, тогда как капсулы благоприятствуют выделению ФРТ; Альгинатные капсулы показали более высокие уровни пролиферации клеток SaOS-2 по сравнению с гранулами и контрольной группой.
Используя ту же клеточную линию, Celotti и коллеги использовали нейтрализующее ТФРβ антитело, которое уменьшает пролиферацию клеток. Кроме того, может быть разработано долгосрочное контролируемое высвобождение ОТПК и БТФ. Фибриновая архитектура более толстая и более надежная в БТФ, чем ОТПК.
Лиофилированные каркасы ОТПК достигали до 35 дней высвобождения белков в культуре и стимуляции клеточной пролиферации.
Кроме того, было возможно дополнение ОТПК конъюгированным с гепарином фибриновым биоматериалом, обеспечивающим замедленное высвобождение ФРФ-2, ФРТ-BB и ФРЭС. В модели закрытия раны у мышей эта комбинация обеспечивала более быстрое закрытие раны и регенерацию, подчеркивая потенциальную роль ОТПК в лечении хронических ран кожи. Возможность контролировать композиционное высвобождение ОТПК и БТФ, а также его временное окно может таким образом совершенствовать клеточный подход в тканевой инженерии.
Богатая тромбоцитами плазма в тканевой инженерии
Богатая тромбоцитами плазма и плазма богатая фибрином показали многообещающие результаты в различных способах применения стволовой клеточной тканевой инженерии и регенеративной медицины, но результаты были противоречивые. В настоящее время проводится более дюжины крупных клинических испытаний, посвященных изучению регенеративного потенциала ОТПК, который поможет выявить потенциальные выгоды и ловушки этого кровяного производного. Этот раздел обзора направлен на обсуждение достижений в нашем понимании влияния ОТПК на клеточную пролиферацию, дифференцировку, высвобождение фактора роста, воспаление и хемотаксис.
Пролиферация клеток
Было показано, что богатая тромбоцитами плазма увеличивает пролиферацию во всех исследованных типах клеток, в том числе дифференцированных клеток, таких как остеобластоподобные клетки и хондроциты, клетки периодонтальных связок, сухожильные клетки, преадипоциты и эндотелиальные клетки, а также мультипотентные клетки, такие как мезенхимальные стволовые клетки и стволовые клетки, полученные из жировых клеток.
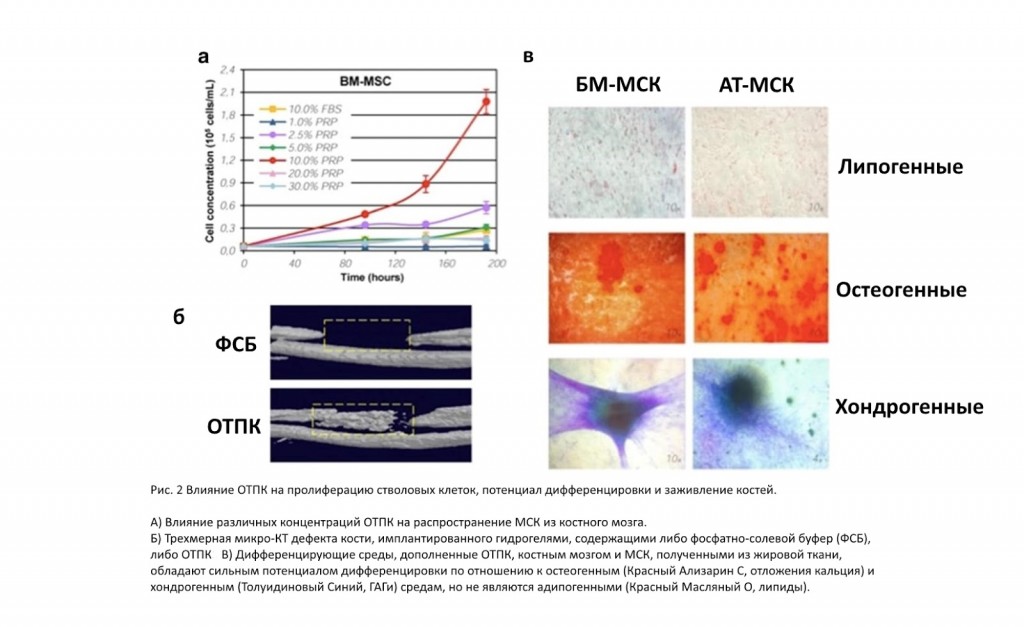
ОТПК опосредует это увеличение пролиферации дозозависимым образом. Было показано, что остеобласты увеличивают пролиферацию с помощью ОТПК, хотя одно исследование показало, что в бедной тромбоцитами плазме (50%) имеется большее усиление клеточной пролиферации. В альвеолярных костных клетках более высокие концентрации ОТПК подавляли пролиферацию, тогда как низкие концентрации (1-5%) стимулировали пролиферацию. Как бы то ни было, ОТПК оказывает стимулирующее действие на пролиферацию стволовых клеток, таких как мезенхимальные стволовые клетки (МСК) (Рис.2а), проявляя также зависимость от дозы. Murphy и др. показали, что ОТПК, полученная из пуповинной крови человека, имела более высокие скорости пролиферации у МСК по сравнению с нормальной кровью. Малые концентрации (0,1%) пуповинной ОТПК имели максимальное увеличение пролиферации по сравнению с различными комбинациями рекомбинантных факторов роста.
Хотя стимуляция пролиферации стволовых клеток может быть многофакторным процессом из-за многочисленных различных стимулирующих пролиферацию молекул, в качестве потенциального механизма было идентифицировано продвижение прогрессии клеточного цикла Stat3 / p27Kip1. Более того, ОТПК может также косвенно стимулировать пролиферацию, усиливая стволовоклеточные адгезии, подчеркивая использование ОТПК в усилении стволовоклеточной связи в биоматериалах. Помимо пролиферации, ОТПК может способствовать увеличению скорости роста клеток за счет снижения гибели клеток. В частности, добавка ОТПК снижала экспрессию и апоптоз Bcl-2.
Различные экспериментальные модели на животных подтвердили возможности и ограничения использования ОТПК для пролиферации клеток. В модели диабетического перелома бедра крысы (некритичного) добавление ОТПК в месте перелома усиливало клеточную пролиферацию. В другом исследовании, ОТПК, выпущенная из желатиновых гелей, имплантированных в костный дефект, способствовало регенерации кости (Рис.2б). Однако в модели с дефектом длинной кости ОТПК, объединенная с коллагеновым каркасом, не оказывала значительного воздействия на объем костей, минеральную плотность и механическую жесткость. Эти потенциально противоречивые отчеты могут указывать на тяжелые последствия различных составов факторов роста среди отдельных пациентов, что подчеркивает нерегулярность состава ОТПК и ее клинических последствий. В совокупности эти сообщения указывали на то, что ОТПК оказывает стимулирующее действие на клеточную пролиферацию в различных тканях. Тем не менее, необходимы дальнейшие усилия, чтобы понять, как различные препараты ОТПК, индивидуальные вариации и специфический состав ОТПК вносят свой вклад в эти эффекты. Более того, мало известно о пролиферативных эффектах и механизмах БТФ, действующих на стволовые клетки.
Дифференцировка клеток
Богатая тромбоцитами плазма может оказывать сильное влияние на дифференцировку различных стволовых клеток. Выделение ОТПК показало особую склонность к стимуляции дифференцировки стволовых клеток в типы клеток скелета, такие как хрящ, кость, кровеносный сосуд и сухожилие.
Периодонтальные связочные клетки, а также остеобластоподобные клеточные линии SaOS-2 и HOS показали увеличение активности щелочной фосфатазы и увеличение дифференцировки в клетки, формирующие минерализованную ткань при воздействии ОТПК. Более того, эти клеточные линии быстро увеличивали экспрессию маркеров остеогенной дифференцировки, таких как остеопонтин, остеопротегерин и транскрипционный фактор малорослости №2. В стволовых клетках, полученных из жировых клеток, на более поздних стадиях (21 день) было обнаружено ОТПК для стимуляции остеогенной дифференцировки путем увеличения щелочной фосфатазы, остеопонтина, остеокальцина и транскрипционного фактора малорослости дозозависимым способом. Интересно, что воздействие ОТПК не только увеличивало остеогенный потенциал стволовых клеток, но также уменьшало их вероятность липогенной дифференциации (Рис.2в). Предполагается, что ОТПК проявляет свою остеогенную стимуляцию через синергические эффекты с морфогенетическим белком кости №2, №4, №6 и №7 (МБК).
Действительно, МБК оказывают более сильное влияние на дифференцировку остеобластов, чем ОТПК, но демонстрируют увеличенные эффекты при добавлении ОТПК. Это делает ОТПК подходящим синергическим агентом для управления остеогенезом стволовых клеток для применения в костной ткани. Помимо остеогенеза, влияние ОТПК на хондрогенез стволовых клеток хорошо охарактеризовано. Добавление ОТПК к растущим хондрогенным клеткам-предшественникам позволяет длительно поддерживать хондрогенный потенциал. Более того, добавление ОТПК к хондрогенным средам увеличивало хондрогенный потенциал МСК. Включение ОТПК в полигликолевую кислотно-гиалуроноподобную структуру увеличивало экспрессию хондрогенных маркеров коллагена II и IX, аггрекана и протеина олигомерной матрицы хряща. Кроме того, добавление лизата тромбоцитов воздействовало на МСК, инкапсулированные в декстран-тирамине путем их хемотаксического привлечения, а также путем улучшения их последующей адгезии и эффективности хондрогенной дифференцировки. Эффекты БТФ на хондрогенез и остеогенез остаются в основном неизученными. Более того, вклад ОТПК и БТФ в дифференциацию стволовых клеток в различные ткани не был систематически исследован и поэтому оставался в значительной степени неизвестным
Ангиогенез
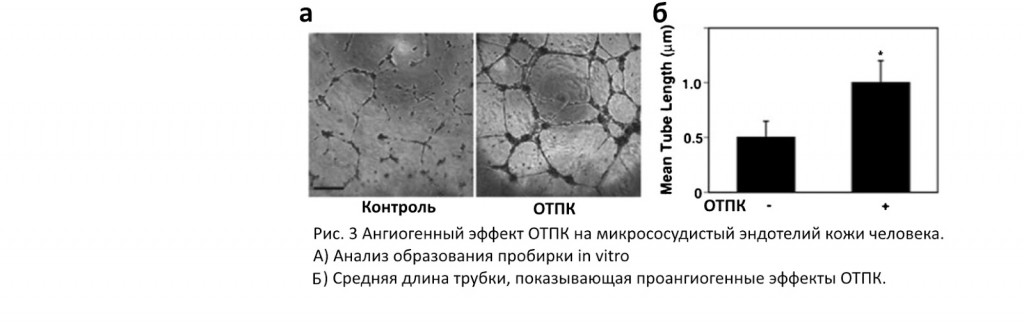
Известно также, что богатая тромбоцитами плазма стимулирует ангиогенез, который является неотъемлемой частью регенерации тканей и рекрутирования стволовых клеток. Это увеличивает миграцию и образование сосудов у эндотелиальных клеток пупочной вены человека. Богатая тромбоцитами плазма показала в сокультивировании эндотелиальных клеток-предшественников (ЭКП) и стволовых клеток пульпы зуба увеличение секреции ФРЭС и ФРТ, тем самым стимулируя васкулогенез и стимулируя ЭКП для образования сосудоподобных структур. Дело в том, что богатая тромбоцитами плазма содержит высокий уровень ангиопоэтина 1 (Ang1), который опосредует ангиогенез. Ингибирование передачи сигналов Ang1-Tie2 подавляло проангиогенный эффект ОТПК. Интересно, что богатая тромбоцитами плазма предотвращает индуцированный эндотоксином отек легких через тот же путь, который может быть обусловлен потенциалом ОТПК для стабилизации сосудистой целостности и проницаемости. ОТПК уменьшало разрушение клеточной целостности клеток, индуцированное воспалительными цитокинами. Действительно, добавление ОТПК последовательно ассоциировалось с улучшением ангиогенеза в различных моделях и методах применения (Рис. 3). Следовательно, производные крови, такие как ОТПК, могут быть рассмотрены как аутологичный конкурент традиционно используемого рекомбинантного белка ФРЭС для индукции образования кровеносных сосудов в имплантированных биоинженерных конструкциях.
Хемотаксис и воспаление
Помимо прямого влияния ОТПК и БТФ на пролиферацию, дифференцировку и ангиогенез, они также влияют на заживление раны косвенно посредством хемотаксического рекрутирования клеток и локального контроля воспалительной среды. Действительно, сообщалось, что ОТПК хемотаксически привлекает МСК человека. Другой перспективный хемотаксический эффект наблюдался также в модели исцеления крысиных сухожилий, где ОТПК был способен набирать циркулирующие клетки крови и помогать в начальных стадиях заживления сухожилий. Кроме того, было показано, что ОТПК может привлекать моноциты периферической крови дозозависимым образом, что также приводит к изменениям профиля высвобождения провоспалительных цитокинов у моноцитов. Несколько исследовательских групп сообщили о способности ОТПК смягчать воспаление. Активированная ОТПК показала высокие уровни фактора роста гепатоцитов (ФРГ), ИЛ-4 и ФНОα. В хондроцитах высокие уровни ФРГ и ФНО-α, индуцированные ОТПК, снижали трансактивирующую активность NF-κB, действуя как противовоспалительный триггер. Кроме того, в остеоартритных хондроцитах, вызванных ИЛ1B, ОТПК снижала уровни активации NF-κB и имела множественные противовоспалительные эффекты. В другой модели остеоартрита, использующей остеоартритный хрящ и синовию от пациентов, ОТПК, с лейкоцитами или без них, имела похожие противовоспалительные эффекты. Более того, в сухожильных клетках, обработанных ИЛ-1B, ОТПК индуцировала экспрессию ФРЭС, цитокина А5 и ФРГ и уменьшала провоспалительные цитокины ИЛ-6, ИЛ-8 и MCP-1.
В совокупности в упомянутых выше докладах подчеркивается роль ОТПК в высвобождении фактора роста и его важность для хемотаксиса и воспаления. Неудивительно, что богатая тромбоцитами плазма рассматривается для лечения воспаления и боли при определенных заболеваниях, например при остеоартрите.
Нейропротекция и другие эффекты
Было обнаружено, что в органных культурах коры головного и спинного мозга ОТПК стимулирует рост аксонов, опосредованный ИФР-1 и ФРЭС, но не ФРТ-AB. Кроме того, ингибирование ТФР-β1 приводит к более быстрому росту аксонов, указывая на то, что ТФР-β1 ингибирует или ухудшает рост аксонов. Помимо роста аксонов, ОТПК обладает нейропротекторными свойствами. В модели ишемического инфаркта головного мозга крысы ОТПК системно или локально обеспечивала нейропротекторный эффект. Однако эффект уменьшения объема инфаркта был выше при местной внутриартериальной инфузии лизата ОТПК по сравнению с системным введением. Кроме того, ОТПК минимизировала неврологические дефициты в той же модели.
ОТПК также показала антимикробную активность, ингибируя рост бактерий. Агаровые пластинки с ОТПК ингибировали начальный бактериальный рост Pseudomonas aeruginosa, Staphylococcus aureus и Streptococcus faecalis. Это ингибирование опосредовано высвобождением антибактериального хемокинового лиганда 1, 3 и 5. Интересно, что ОТПК, как было показано, усиливает маркеры плюрипотентности и уменьшает экспрессию специфичных маркеров в человеческих МСК, человеческих мышечных клетках-предшественниках и стволовых клетках жировой клетчатки. Более того, было показано, что ОТПК повышает жизнеспособность клеток во время криоконсервации. Таким образом, ОТПК усиливает экспансию стволовых клеток, минимизируя потерю их стволовости.
Клинические выводы
Богатая тромбоцитами плазма и плазма богатая фибрином имеют множество клинических применений в регенеративной медицине. В многочисленных исследованиях in vitro и животных сообщалось, что эти продукты, полученные из крови, могут стимулировать дифференцировку стволовых клеток по некоторым клеточным линиям. В настоящее время клинические исследованиям подвергаются ОТПК, перегруженные стволовыми клетками. В частности, они исследуются при челюстно-лицевых процедурах, ортопедических операциях, а также при раневой или ожоговой терапии. Сообщается, что богатая тромбоцитами плазма ускоряет восстановление хронической язвы кожи, а также улучшает процесс приживления жира. Например, пациентов с язвами нижних конечностей обрабатывали ОТПК, смешанный с основой жировой ткани, или контрольной обработкой, состоящей из коллагена, смешанного с гиалуроновой кислотой. Через 7 и 10 недель раны, обработанные ОТПК, полностью реэпителизовались соответственно у 61,1 и 88,9% по сравнению с 40 и 60% в контрольной группе. Аналогичное исследование проводилось для того, чтобы понять как богатая тромбоцитами плазма влияет на лечение различных челюстно-лицевых дефектов. Пациенты получали либо лечение с ОТПК, либо пересадку жира, либо только трансплантацию жира. Через год после операции, выживание трансплантата и поддержание трехмерной структуры ткани составило 70% в группе, получавшей ОТПК, по сравнению с 31% в контрольной группе.
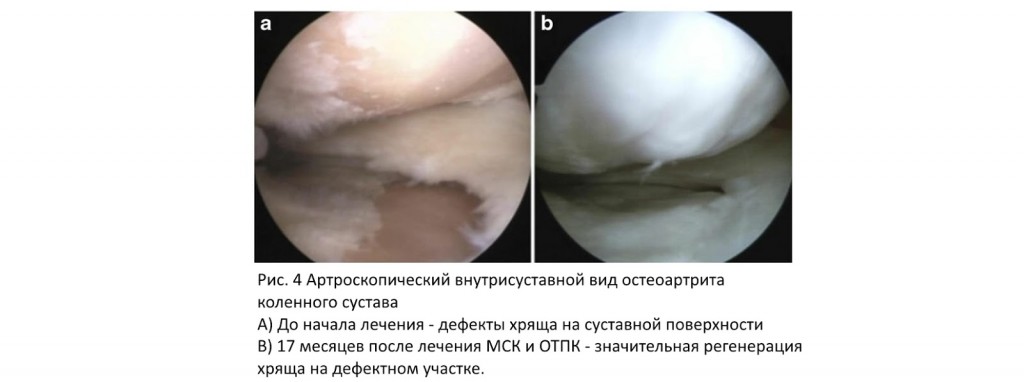
В ортопедии богатая тромбоцитами плазма регулярно включается как биоактивный компонент. Например, в клиническом испытании по лечению деформаций 21 пациентке была проведена остеотомия большеберцовой кости и терапия МСК в сочетании с инъекцией ОТПК, в то время как у 23 пациентов контрольной группы была остеотомия большеберцовой кости с инъекцией только ОТПК. Это продемонстрировало, что добавление МСК значительно уменьшало как боль, так и фиброзное образование хряща (Рис. 4). Аналогично, Koh и др. лечили пациентов с остеоартритными коленями, используя комбинацию МСК, выделенных из интрапателлярной жировой подушки, с ОТПК, тогда как контрольные пациенты получали инъекцию ОТПК без добавления стволовых клеток. Смесь вводили в остеоартритные колени один раз в неделю на срок до 3 недель. Краткосрочные результаты показали, что добавление МСК уменьшало боль и улучшало функцию сустава у пациентов, прошедших лечение. Хотя в этих конкретных исследованиях изучался потенциальный лечебный эффект МСК, клинические эффекты ОТПК по прежнему должны были быть полностью изученными. Несмотря на это, исследователи смогли подтвердить свою правоту в безопасности клинического применения ОТПК.
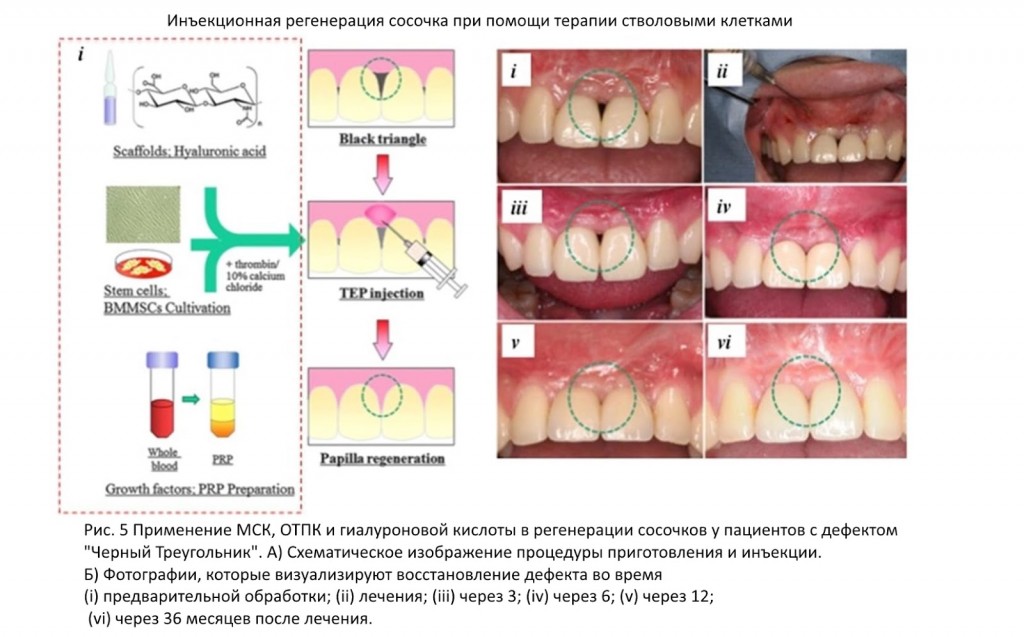
В области челюстно-лицевой хирургии/ стоматологии богатая тромбоцитами плазма изучался для лечения «черного треугольника», который проявляется появлением межпроксимального расстояния между зубов. Десять пациентов получили от одной до пяти инъекций и наблюдались в течение периода до 69 месяцев. Все пациенты сообщили о высоком удовлетворении косметическими результатами без каких-либо серьезных побочных эффектов. Пациенты продемонстрировали различную степень регенерации и заполнения дефекта, у двух пациентов была полная регенерация (Рис. 5). Однако роль клеток-предшественников в этой регенерации оставалась в основном неисследованной.
Таким образом, ранние клинические результаты показали, что кровяные производные на тромбоцитах, такие как ОТПК и БТФ, являются перспективными дополнениями для современных терапий на основе стволовых клеток. В частности, они демонстрируют, что представляют собой безопасный и легкодоступный источник факторов роста.
Задачи на будущее
Несмотря на то, что в нескольких докладах подробно описываются преимущества производных крови в области ортопедии, дерматологии и сосудистых операций, все еще предстоит решить несколько задач.
Состав производных крови характеризуется относительно сильным внутриорганизменным изменением. Более того, вариация состава коррелирует с возрастом, полом и сопутствующими заболеваниями пациента. Кроме того, остается неясным, как эти изменения влияют на поведение стволовых клеток in vivo. Поэтому более подробная характеристика ОТПК и БТФ крайне необходима, чтобы обеспечить более надежные и прогнозируемые клинические результаты. В дополнение к внутриорганизменному варианту в предыдущих отчетах подчеркивалось, что на состав у каждого пациента также влияет последующая методика приготовления.
К сожалению, в настоящее время не существует общепринятого стандартизованного протокола. Эти несоответствия снижают сопоставимость и воспроизводимость различных исследований ОТПК. Эти проблемы могут быть решены путем систематического анализа с высокой пропускной способностью. В качестве альтернативы можно утверждать, что создание нескольких пулов доноров могло бы смягчить эту проблему, но этот подход будет осуществляться за счет его аутологичного характера.
Помимо состава производного крови, его доставка может сильно повлиять на его влияние на стволовые клетки и регенерацию тканей. В частности, характеристики биоматериала, такие как жесткость, разлагаемость, пористость и биоактивность, могут, вероятно, изменять влияние производного крови на стволовые клетки и регенерацию тканей. Хотя в нескольких исследованиях началось изучение концепции объединения ОТПК и БТФ с биоматериалами, комплексные или систематические подходы не выполнялись. Кроме того, биоматериалы могут быть использованы для преодоления проблемы продления срока действия ОТПК и БТФ. В настоящее время их поставка зависит от плохо контролируемого массового выпуска. Вследствие этого длительное лечение требует множественных обработок, например многочисленных инъекций. Это приводит к сильно флуктуирующим концентрациям фактора роста, что ухудшает клиническую предсказуемость. Биоматериалы могут выступать в качестве устройств с контролируемым высвобождением, что позволит обеспечить устойчивую или даже быструю доставку этих коктейлей с факторами роста. Кроме того, можно предположить, что биоматериалы могут ковалентно связывать специфические факторы роста для локального сохранения высоких уровней этих молекул.
Вывод
Производные крови, в частности, богатая тромбоцитами плазма, представляют собой многообещающий источник естественных аутологичных факторов роста, которые усиливают пролиферацию, миграцию и дифференцировку стволовых клеток. Кроме того, клинические испытания подтвердили безопасность богатой тромбоцитами плазмы, а также ее способность улучшать клинические результаты терапии на основе стволовых клеток. Однако, приобретая контроль над производными крови, их химический состав остается ключевой задачей для достижения воспроизводимых и предсказуемых клинических результатов.
Перевод статьи Elham Masoudi, Jeroen CH Leijten, Ali Khademhosseini «Platelet-Rich Blood Derivatives for Stem Cell-Based Tissue Engineering and Regeneration», 02/2016.
