Регенерация в пародонтологии — одно из ключевых направлений современной науки и клинической практики. В данной статье представлена вторая часть материала по этой важной теме.
Концепции регенерации
Один из первых методов, используемых в попытках получить новое прикреплением был скейлинг и обработка корней (т.е. удаление патологически измененного корневого цемента и эпителия кармана). Исследования с участием людей (например, McCall 1926; Orban 1948; Beube 1952; Waerhaug 1952; Schaffer & Zander 1953; Carranza 1954, 1960) и на животных (например, Beube 1947; Ramfjord 1951; Kon et al.1969) показали, что этот тип пародонтальной терапии привел не только к улучшению состояния десны, но и к снижению первоначальной глубины кармана.
Это уменьшение глубины пародонтального кармана считалось отчасти результатом усадки первоначально воспаленной десны, но частично также с эффектом формирования нового прикрепления соединительной ткани в апикальной части кармана.
Возможность получения нового прикрепления стала широко применяться после работ Prichard (1957), в которых формирование нового прикрепления во внутрикостных дефектах тканей пародонта были описаны как предсказуемый результат лечения. Были представлены 17 случаев, из которых 4 были подвергнуты повторной хирургической процедуре. В них было выявлено формирование новой костной ткани в области дефектов.
Техника Prichard (1957, 1960) была использована только для лечения трехстеночных внутрикостных дефектов, а полученные результаты предполагают что морфология дефектов была важна для создания предсказуемого прогноза. Goldman and Cohen (1958) представили классификацию внутрикостных дефектов тканей пародонта, которая была основана на количестве костных стенок, окружающих дефект, были выделены трех- двух или одностеночные дефекты или их комбинации (рис. ниже).
Техника Prichard (1957, 1960) включала откидывание лоскута, чтобы получить доступ к дефекту, удаление грануляционной ткани внутри дефекта, скейлинг и полировка корней. Для улучшения регенерации кости были сделаны небольшие перфорации с помощью бора в нескольких местах кости. Лоскут ушивают для достижения полного покрытия дефекта. Многие клинические исследователи утверждают, что недостаточно свидетельств успешного восстановления прикрепления (Patur &Glickmann 1962; Wade 1962, 1966; Ellegaard & Löe1971). Patur и Glickmann (1962) сообщили о клиническом исследовании, включающим 24 внутрикостных дефекта, обработанных по методике Prichard . Результат оценивали путем сравнения предоперационных и послеоперационных рентгенограмм, измерений уровня альвеолярного отростка, прилегающего к корню. Также изучали образцы, взятые во время операции и после операции после откидывания щечных и язычных лоскутов.
Авторы сообщили, что произошло восстановление прикрепления в двухстеночных и трехстеночных дефектах, в одностеночных дефектах такого эффекта не наблюдали. Результаты исследования Ellegaar и Löe (1971), включающие 191 дефект у 24 пациентов при заболеваниях пародонта указали, что регенерация, определенная рентгенологически и зондированием пародонта имела место примерно в 70% случаев в трехстеночных дефектах, в 40% в комбинированных дефектах и в 45% случаев при двухстеночных.
В более позднем исследовании Rosling et al. (1976) 124 внутрикостных дефекта у 12 пациентов были прооперированы с помощью модифицированого лоскута Widman (Ramfjord & Nissle 1974). После лечения пациентов вызывали два раза в месяц для профессиональной гигиены зубов. Повторное обследование, проведенное клинически и на рентгенограммах через 2 года после терапии, продемонстрировало заполнение костной тканью 2,3-стеночных дефектов. Авторы предположили, что этот рост кости также был связан с образованием нового прикрепления и приписывают успешное лечение в основном оптимальному уровню гигиены полости рта, который поддерживался у всех пациентов во время заживления. Клиническое исследование с почти идентичными результатами было представлено Polson and Heijl (1978). Результаты нескольких гистологических исследований на животных и людях, с другой стороны, указывают на то, что формирование нового пародонтального прикрепления отнюдь не предсказуемо после открытого кюретажа или лоскутной операции (Listgarten & Rosenberg 1979;Caton & Nyman 1980; Caton et al. 1980; Steiner et al.1981; Stahl et al. 1983; Bowers et al. 1989a)
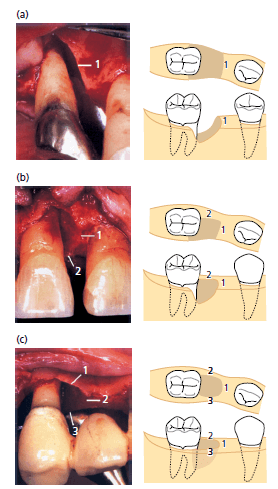
Рис. 1. Прогрессирование пародонтита с разной скоростью на соседних поверхностях зубов приводит к развитию внутрикостных дефектов. В зависимости от количества окружающих костных стенок такие дефекты классифицируются как одностенные (а), двухстенные (b) или трехстенные дефекты (с)
Графтинг
В ряде клинических испытаний и экспериментах на животных, лоскутная операция комбинировалась с применением костных трансплантатов или материалов в предварительно обработанный костный дефект с целью стимуляции регенерации пародонта. Все материалы для трансплантации и имплантации можно разделить на четыре категории:
- Аутогенные трансплантаты: трансплантаты, перенесенные из одного участка к другому внутри одно и того же индивидуума. Этот тип графтинга предполагает использование кортикальной и губчатой костной ткани и костного мозга. Материал получается из интро- или экстраоральных донорских участков.
- Аллогенные трансплантаты: трансплантаты, полученные от генетически различных представителей одного вида. Например, замороженная губчатая костная ткань или костный мозг.
- Ксеногенные трансплантаты: трансплантаты, полученные от донора другой вид.
- Аллопластические материалы: синтетические или неорганические имплантаты, которые используются в качестве заменителей костной ткани.
Применение различных графтов обосновано тем, что при их применении с одной стороны стимулируется образование новой костной ткани, а с другой формирование нового прикрепления. Это связано с тем, что эти материалы (1) содержат остеообразующие клетки (остеогенез), (2) служат каркасом для формирования кости (остеокондукция), (3) матрица трансплантатов содержит костный вещества‐индукторы (остеоиндукция) (Urist 1980; Brunsvold & Mellonig 1993).
Регенерация прикрепления после графтинга основана на представлении о том, что клетки костной ткани способны формировать новый цемент со вставками коллагеновых волокон на поверхностях корней, ранее вовлеченных в пародонтит (Melcher et al. 1987). Это мнение вступает в противоречие с современными знаниями о биологии заживления в пародонтологии. Известно, что необходимым условием для формирования нового прикрепления является повторное заселение отделенной поверхности корня клетками периодонтальной связки. Это означает, что все лечебные процедуры, связанные с размещением костных трансплантатов или заменителей кости, основываясь на биологической концепции, не могут объяснить регенерацию пародонта.
Эффект от применения костных трансплантатов или аллопластических материалов для регенерации пародонта в большинстве отчетов основывался на данных осмотра, в то время как гистологических доказательств формирования прикрепления было очень мало.
Данные отчетов сильно различаются и представленные документы, как правило, состояли из данных пред и послеоперационного зондирования, уровня прикрепления (PAL), рентгенографических описаний.
Биомодификация поверхности корня
Многие исследования были направлены на изучение состояния поверхности корня, измененного пародонтитом. Воздействие на него должно быть таким, чтобы способствовать формированию новой соединительной ткани. Удаление бактериальных отложений, камней и эндотоксинов из цемента считается необходимым для формирования новой соединительной ткани (Garrett 1977). Тем не менее, было исследовано Stahl et al. (1972), что деминерализация поверхности корня с обнажением коллагена дентина, будет способствовать отложению цемента, индуцируя мезенхимальные клетки в соседних тканях, которые в свою очередь будут дифференцироваться в цементобласты.
Биологическая концепция заключается в том, что воздействие коллагеновых волокон матрицы дентина может способствовать адгезии сгустка крови к поверхности корня и тем самым способствует миграции фибробластов. Однако эта концепция сомнительно соответствует современным знаниям о заживлении пародонта, так как нет доказательства того, что воздействие коллагеновых волокон матрицы дентина облегчает репопуляцию поверхности корня клетками, происходящими из периодонтальной связки. Как упоминалось ранее, клетки периодонтальной связки необходимы для создания нового прикрепление соединительной ткани.
Несколько исследований с использованием различных моделей животных продемонстрировали улучшенные гистологические результаты после применения лимонной кислоты и тетрациклина для деминерализации поверхности корня (Register & Burdick 1976; Crigger et al. 1978; Polson & Proye 1982; Claffey et al. 1987). Тем не менее, в исследовании на собаках, где естественно возникающие дефекты фуркации обрабатывали лимонной кислотой, несколько образцов продемонстрировали анкилоз и резорбцию корня (Bogle et al. 1981). Этот вывод подтверждает выводы Magnusson et al. (1985) у обезьян, где лимонная кислота наносилась на поверхность корня с последующим апикальным смещением лоскута. Результаты оценивали после 6 месяцев. Эти исследователи также обнаружили резорбцию корня на 28 из 40 исследованных поверхностей и 21 из них также показал анкилоз.
Новое прикрепление после обработки лимонной кислотой для деминерализация поверхности корней было продемонстрировано гистологически у людей (Cole et al. 1980; Frank et al. 1983; Stahl et al. 1983; Stahl & Froum 1991). Cole и соавт. (1980) показали гистологическое доказательство нового прикрепления соединительной ткани и образование соединительной ткани апикальней контрольной выемки на поверхности корня. Однако, несмотря на гистологические доказательства регенерации после биомодификации поверхности корня лимонной кислотой, в результате контролируемых клинических исследований не удалось показать каких-либо улучшений в клинических условиях по сравнению с контрольной группой, где не использовали кислоту (Moore et al. 1987; Fuentes et al. 1993).
Модификация корневой поверхности с использованием местно наносимых белков эмалевого матрикса (Emdogain®) во время операции и после деминерализации этилендиаминтетрауксусной кислотой (ЭДТА) были введены для усиления регенерации пародонта. Биологическая концепция заключается в том, что применение эмалево-матричных белков (включая амелогенины) может способствовать регенерации пародонта, потому что они имитируют события, которые происходят во время синтеза тканей пародонта (Hammarström 1997; Gestreliusи другие. 2000). Это мнение основано на выводе о том, что клетки эпителиального Гертвиговского влагалища и белки эмалевого матрикса на поверхности корня являются клетками-предшественниками цемента, и что эти белки являются инициирующими факторами образования цемента.
Коммерчески доступный продукт Emdogain®, очищенный кислотный экстракт свиного происхождения, содержит производные матрицы эмали(EMD), которые должны способствовать регенерации пародонта. Тем не менее, не совсем ясно, как эта концепция сочетается с современными знаниями о заживлении пародонта, так как не было предоставлено никаких доказательств того, что клетки, полученные из периодонтальной связки необходимы для заселения поверхности корня после обработки. Тем не менее, исследование на собаках (Araùjo et al. 2003), где повторно имплантировали корни, которые были извлечены и лишены жизненно важных цементобластов и впоследствии обработаны EMD, показало, что не удалось предотвратить анкилоз и резорбции корня. Это указывает на то, поверхности не заселялись клетками способными образовывать цемент. В последующем исследовании in vitro также не удалось подтвердить, что EMD имеют какое-либо существенное влияние на пролиферацию клеток периодонтальной связки (Chong et al. 2006).
В отчетах, описывающих серии случаев, где отмечалось увеличение клинического прикрепления на 4–4,5 мм и 70% заполнения внутрикостных дефектов, были зарегистрированы после лечения с EMD (Heden et al. 1999; Heden 2000). В многоцентровом клиническом исследовании с участием 33 пациентов с 34 парными внутрикостными дефектами применение EMD привело к увеличению прироста PAL( прикрепленной десны) на 2,2 мм и статистически значимому приросту костной ткани (2,6 мм) по сравнению со случаями, когда только откидывался лоскут и проводилось удаление зубных отложений. Оценка проводилась через 36 месяцев клинически и рентгенографически (Heijl et al. 1997). Подобные результаты были зарегистрированы в другом клиническом испытании(23 пациента) (Froum et al. 2001). В этом исследовании уменьшение глубины зондирования (PPD) на 4,9 мм, PAL прирост на 4,3 мм и прирост кости на 3,8 мм (оценивается после повторной операции) наблюдались после применения EMD в 53 внутрикостных дефектов. Эти значения были статистически значимее, чем полученные после лоскутной операции (2,2 мм, 2,7 мм и 1,5 мм соответственно с 31 дефектом).
В проспективном многоцентровом рандомизированном контролируемом клиническом исследовании сравнивали клинические исходы лоскутной операции с сохранением сосочков (SPPF) с применением или без применения белков эмалевого матрикса (Tonetti et al.2002). Всего 83 тестовых и 83 контрольных пациента с аналогичными исходными условиями тканей пародонта и характеристиками дефектов были прооперированы либо SPPF + Эмдогейн® либо только с SPPF. Изменения проявлялись значительно более высоким уровнем клинического прикрепления(CAL), чем в контрольной группе (3,1 ± 1,5 мм и 2,5 ± 1,5 мм соответственно).
Когда применение EMD сравнивалось с НТР техникой, были получены аналогичные клинические улучшения. В рандомизированном контролируемом клиническом исследовании Pontoriero et al. (1999) сравнили EMD с НТР, при этом использовались как резорбируемые (два вида: Guidor и Resolut), так и нерезорбируемые (e-PTFE) мембраны во внутрикостных дефектах. Через 12 месяцев не было никаких существенных различий между группами. Применение EMD привело к уменьшение глубины зондирования на 4,4 мм и увеличению PAL на 2,9 мм, в то время как соответствующие значения из участков, где применялись мембраны (обе группы НТР объединены) были 4,5 мм и 3,1 мм соответственно. Silvestri et al. (2000) сообщили о снижении PPD на 4,8 мм и увеличении PAL на 4,5 мм после применения EMD во внутрикостных дефектах против 5,9 мм и 4,8 мм соответственно после применения направленной тканевой регенерации с нерассасывающимися мембранами. Подобные результаты были сообщены другими исследователями (Sculean et al. 1999a, b; Silvestri et al.2000, 2003; Sanz et al. 2004). Существуют исследования, показывающие, что после применения EMD при внутрикостных дефектах, клинические улучшения могут достигаться путем дополнительного использования костных трансплантационных материалов (Zucchelli et al. 2003; Gurinsky et al. 2004; Trombelli et al. 2006), хотя другие не смогли продемонстрировать положительный эффект этого сочетания в лечении (Sculean et al. 2005).
Гистологическое подтверждение образования нового цемента с вплетением коллагеновых волокон на пораженной ранее пародонтитом поверхности корня и формирование новой альвеолярной кости в образцах человека были продемонстрированы после лечения EMD (Mellonig 1999; Sculean et al. 1999b). Однако в исследование Mellonig (1999) восстановление произошло бесклеточным цементом на поверхности корня, в то время как образовавшийся цемент в исследовании Sculean et al. (1999b) был преимущественно клеточный. Способность EMD к активации регенерации была подтверждены в контролируемых экспериментах на животных, после обработки внутрикостных и фуркационных дефектов(Hammarström et al.1997; Araùjo & Lindhe 1998; Sculean et al. 2000). В более позднем исследовании на обезьянах было показано, что совместное применение EMD и аутогенных костных трансплантатов может улучшить регенерацию пародонта по сравнению с одной только лоскутной операцией (Cochran et al. 2003).

Рис. 2. а) Микрофотография дефекта фуркации III степени у собаки после биомодификации корневой поверхности эмалевым матричным протеином и покрытием рассасывающейся мембраной. Дефект был полностью восстановлен костной тканью (NB), периодонтальной связкой (P) и новым цементом (NC). Стрелки указывают на апикальное расширение поражения. b) цемент (NAC), образованный на поверхности корня в апикальной части дефекта, бесклеточный по структуре с включением внешних коллагеновых волокон (ECF), в то время как (c) новый клеточный цемент образовался в корональной части (NCC)
Направленная тканевая регенерация
Экспериментальные исследования (Karring et al. 1980; Nyman 1980; Бузер 1990a, b; Warrer et al. 1993), описанные ранее документально, подтверждают, что клетки-предшественники для образования нового соединительнотканного прикрепления находятся в периодонтальной связке. Следовательно, следует ожидать, что формирование нового прикрепления будет предсказуемо достигаться, если такие клетки заселяют поверхность корня во время заживления. Эта точка зрения была подтверждена в исследовании на обезьянах, у которых соединительные ткани десны и эпителий десны были изолированы от контакта с поверхностью корня во время заживления с помощью мембран (Gottlow et al. 1984). После редукции поддерживающих тканей вокруг выбранных экспериментальных зубов поверхности корней подвергались воздействию зубного налета в течение 6 месяцев. Затем лоскут был откинут, а поверхности корней обработаны кюретами. Коронки зубов были удалены и корни были погружены в лунки. До полного закрытия раны была установлена мембрана в области обработанных поверхностей корней на одной стороне челюсти для того, чтобы (1) предотвратить контакт соединительной ткани с поверхностью корня во время заживления и (2) обеспечить пространство для роста связки. С противоположной стороны мембраны не были установлены. Гистологический анализ после 3 месяца заживления показал, что корни, покрытые мембранами имеют значительный прирост нового прикрепления, в отличие от непокрытых корней (рис. ниже). В 4 из 9 тестовых корней новый цемент покрывал всю длину корня. Во всех контрольных образцах новообразованный цемент представлен многоядерными клетками и резорбционными полостями. В 1 контрольном образце практически половина корня была резорбирована. Корональный рост альвеолярного отростка произошел в различной степени в тестируемых и контрольных корнях, и никакой связи не обнаружено между количеством нового цемента и степенью восстановления кости. В этом исследовании предполагалось, что исключение эпителиальных и десневых клеток соединительной ткани из зоны заживления путем использования физического барьера может позволить направлять клетки периодонтальной связки для заселения корневой поверхности. Это исследование обеспечило основы для клинического применения принципа лечения, называемого «направленной тканевой регенерацией» (GTR).
Таким образом, лечение по протоколу НТР включает в себя размещение физического барьера так, чтобы гарантировать, что пораженная в прошлом пародонтитом поверхность корня заселялась клетками из периодонтальной связки.
Впервые лечение по протоколу НТР у людей было проведено Nyman et al. (1982). В силу обширной деструкции тканей пародонта, зуб планировалось удалять. Это давало возможность получения гистологических образцов результата исследования. После откидывания лоскута проводилось удаление отложений, грануляций, в результате был получен дефект с пародонтальным карманов 11 мм. До тог , как лоскут был мобилизирован была уложена мембрана с целью закрыть обработанную поверхность корней.
Гистологический анализ через 3 месяца заживления обнаружил формирование нового цемента с вставками коллагеновых волокон на ранее обнаженной поверхности коллагеновых волокон (рис. ниже). В более позднем исследовании (Gottlow et al. 1986) были проанализированы 12 случаев лечения по протоколу НТР и для 5 из них была доступна гистологическая документация. Результаты показали, что в большинстве случаев в той или иной степени формировалось новое прикрепление на ранее обработанных зубах. Однако, часто формирование костной ткани было неполным. Изменчивость в результатах была объяснена разным количеством оставшейся периодонтальной связки, морфологией дефекта, техническими трудностями размещения мембраны, десневой рецессией, бактериальным загрязнением мембраны и рана во время заживления.
НТР была изучена в ряде клинических испытаний (Tonetti et al. 2004) при лечении различных пародонтальных дефектах, таких как внутрикостные дефекты (Cortellini & Bowers 1995), дефектов фуркации (Machtei & Schallhorn 1995; Karring & Cortellini 1999) и при локализованной рецессии (Pini-Prato et al. 1996). Регенерация таких дефектов была задокументирована в исследованиях на животных (Gottlow et al. 1990; Araùjo et al. 1998; Laurell et al. 2006) и в нескольких контролируемых клинических испытаниях. Клинические результаты НТР чаще всего оценивается по изменениям CAL, уровню кости, PPD и положению десневого края. В некоторых из исследованиий дефекты фуркаций II и III степени, горизонтальные изменения в уровне клинического прикрепления, уровне кости и глубине кармана так же измерялись. Тем не менее, истинная регенерация пародонта может быть определена только гистологически.
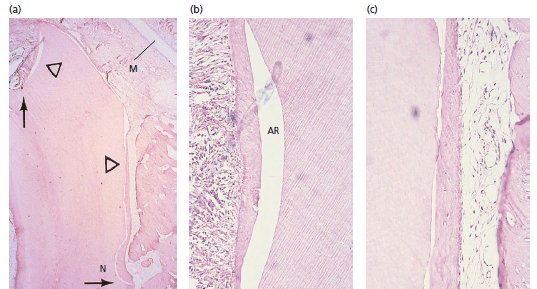
Рис. 3. (а) Микрофотография покрытого мембраной (M) корня. Новообразованный цемент виден по всей длине щечного корня до выемки (N), а также на части коронального cреза (стрелка). (b, c) более высокие увеличения данной области показывают, что коллагеновые волокна вплетаются в новообразованный цемент
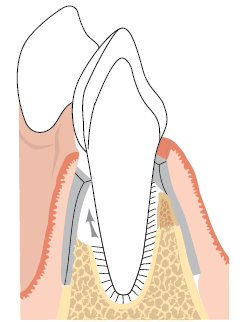
Рис. 4. Ориентировочная схема, показывающая размещение физического барьера, который предотвращает контакт эпителия с поверхностью корня во время заживления. В то же время, мембрана позволяет клеткам периодонтальной связки (стрелка) повторно заселить пораженную корневую поверхность
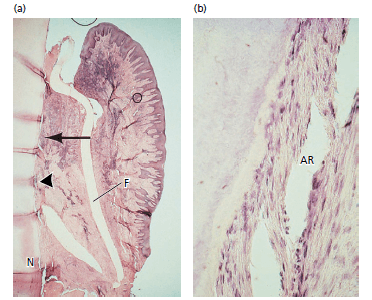
Рис. 5. (а) Микрофотография зуба человека через 3 месяца после регенеративного вмешательства. Мембрана (F). Новый цемент с вставками коллагеновых волокон (около 5мм) от выемки (N) до уровня стрелки. Формирование кости под мембраной отсутствует, вероятно, из-за воспалительного инфильтрата, видимому в тканях, прилегающие к мембране. (b) более высокое увеличение площади указанной стрелкой, показывающее новообразованный цемент с вставкой коллагеновых волокон (AR)
Оценка регенерации пародонта
В большинстве исследований, посвященных влиянию регенеративной хирургии пародонта, результаты оцениваются зондированиеми, радиографическим анализом или повторной операцией. Однако такие методы не обеспечивают доказательства истинного прикрепления (то есть образование цемента и коллагеновых волокон до уровня прикрепления).
Пародонтальное зондирование
Невозможность определить путем зондирования корональный уровень прикрепления была продемонстрирована в нескольких исследованиях (Listgarten et al. 1976; Armitage et al. 1977; Vander Velden & de Vries 1978). Известно, что в воспаленном пародонта зонд не останавливается на уровне коронального прикрепления, а погружается на 0,5 мм или более вглубь соединительной ткани, проходя переход между апикальным расширением эпителия связки и коронарным уровнем прикрепленной десны. После терапии, когда воспалительный процесс устраняется, кончик зонда обычно упирается в области прикрепленной связки. После лечения внутрикостных дефектов, новая кость может образовываться так близко к поверхности зуба, что зонд не может туда проникнуть (Caton & Zander 1976). Таким образом, увеличение PAL после терапии не обязательно означает, что произошла истинная регенерация и восстановление прикрепления, это скорее отражение улучшения общего состояния тканей пародонта, которые проявляют большую резистентность к проникновению зонда.
Радиографический анализ и повторные операции
Заживление внутрикостных дефектов после регенеративной хирургии часто фиксируются измерениями по рентгенограммам, полученным стандартизированным и воспроизводимым образом и/ или в сочетании с повторной операцией. Анализ рентгенограмм перед и после терапии, и осмотра обработанного участка во время повторной операции, безусловно, может дать доказательства образования новой кости. Однако такие «костные пломбы» не доказывают образование нового цемента со вставкой коллагеновых волокон (то есть новой периодонтальной связки). На самом деле было продемонстрировано Caton and Zander (1976) и Moscow et al. (1979) что несмотря на то, что регенерация кости произошла рядом с корнем, имеется соединительный эпителий между новообразованной костью и обработанной поверхностью корня. Это означает, что рентгенографический анализ и оценка костеобразования при повторных операциях — ненадежные методы для определения нового прикрепления.
Гистологические методы
В нескольких исследованиях при использовании биопсии, полученной после различных видов регенеративной хирургии, была исследована регенерация. Гистологический анализ является единственным действительным методом оценки формирования действительно нового связочного аппарата, но он требует, чтобы было определено расположение уровня прикрепления до начала терапии. В нескольких исследованиях, гистологические метки были размещены апикально на поверхности, покрытой камнем во время операции (Cole et al. 1980; Bowers et al. 1989b, в). Обычно метка получается путем создания надреза на поверхности корня при условии, что уровень кости снижен. Хотя метка может не отражать точную степень пораженной пародонтитом поверхности корня до обработки, это считается адекватным ориентиром для оценки нового прикрепления. Было также высказано предположение, что клинические признаки уменьшения глубины зондирования и заполнение костной тканью может быть принято в качестве доказательства регенерации пародонта при оценке процедур НТР (Lindhe & Echeverria 1994). Это предложение было основано на исследовании нового прикрепления в гистологических образцах из биоптатов человека, собранных после обработки НТР (Nyman et al. 1982;Gottlow et al. 1986; Stahl et al. 1990) и на биологической концепции НТР (Karring et al. 1980, 1985, 1993; Nyman et al.1980; Gottlow et al. 1984).
Заключение
Существует доказательство того, что клетки-предшественники, ответственные за восстановление утраченного пародонтального прикрепления присутствует в периодонтальной связке. Следовательно, регенеративная терапия пародонта должна стимулировать повторное заселение пораженной поверхности корня клетками из связки. НТР и обработка поверхности корня с помощью эмалево-матричного протеина представляют собой лучшее сочетании по данным исследований, хотя есть некоторая неопределенность, в том действительно ли эмалево-матричные белки стимулируют истинную регенерацию. Размещение костных трансплантатов или заменителей костной ткани (графтинг) основаны на концепции, которая не может объяснить, как такое лечение приводит к регенерации связки.
По материалам «Concepts in Periodontal Tissue Regeneration» Thorkild Karring, Jan Lindhe
