В данной работе в течение 10 лет оценивались клинические эффекты от лечения 808- и 980-нм диодными лазерами в качестве дополнения к базовому протоколу нехирургических методов лечения пародонтита (NSPTP) при начальной глубине зондирования пародонтальных карманов 6 мм и более.
У пациентов с хроническим пародонтитом удаление поддесневых отложений в сочетании с контролем наддесневой зубной бляшки эффективно для уменьшения глубины кармана и увеличения клинического прикрепления. Увеличение клинического прикрепления и уменьшение кровоточивости при зондировании являются наиболее важными показателями, определяющими успех лечения. Возможность адекватно удалить биопленку и зубной камень для получения биологически приемлемой поверхности корня зависит от глубины кармана, анатомии корня, инструментария, опыта врача и используемой техники. На практике цель состоит в том, чтобы обеспечить наилучший уход для поддержания функционального и эстетического здоровья полости рта, используя наименее инвазивный подход.
Материалы и методы, клинические параметры
Эта контролируемая ретроспективная серия наблюдений была основана на данных пациентов с нарушением функции пародонта, которые в течение 10 лет следовали базовому протоколу нехирургического лечения пародонта.
В целом, в исследование были включены 24 практически здоровых пациента (14 женщин и 10 мужчин) в возрасте от 43 до 84 лет с хроническим пародонтитом средней и тяжелой степени тяжести.
В контрольную группу были включены трое мужчин и 5 женщин со средним возрастом 66 лет (диапазон: 51 -84 года), в то время как в тестовую группу были включены 7 мужчин и 9 женщин со средним возрастом 56 лет (диапазон: 43-72 года). Все пациенты соответствовали следующим критериям включения: возраст от 20 до 89 лет; диагноз — хронический пародонтит средней и тяжелой степени тяжести; отсутствие отягощенного анамнеза; признаки значительной деструкции тканей пародонта на рентгенограммах; отсутствие острой необходимости в ортопедической реабилитации протезами; наличие исходных и последующих клинических фотографий; наличие исходных и последующих рентгенограмм; отсутствие высоких эстетических требований.
Пациенты, которые не соответствовали требованиям и те, кто отказался сотрудничать, были исключены. Все пациенты имели карманы 6 мм и более и минимальную потерю костной массы 50% по крайней мере для двух зубов в исходном состоянии. Все пациенты принимали участие в регулярной поддерживающей пародонтальной терапии с интервалом от 3 — х (в течение первого года) до 4-х месяцев (в течение последующих 9 лет). Все пациенты давали информированное письменное согласие до начала использования клинических данных. Это исследование проводилось в соответствии с Хельсинкской декларацией и последующими поправками к ней.
Клинические параметры
Клинические параметры регистрировались до лечения, через 1 год и через 10 лет после лечения. Один исследователь использовал калиброванный 15-мм зонд для измерения глубина карманов и клинического уровня прикрепления в шести точках на каждом зубе (медиальная щечная, центральная щечная, дистальная щечная, медиальная язычная, центральная язычная и дистальная язычная точки). Кровотечение при зондировании регистрировалось через 10 секунд после пародонтального зондирования. Клинические параметры включали долю участков с положительной пробой кровоточивости, среднее значение глубины карманов и увеличение уровня клинического прикрепления для всей полости рта. Глубина карманов классифицировалась в соответствии с исходным уровнем: умеренная глубина карманов соответствовала 4-6 мм, глубокие карманы были больше или равны 6 мм.
Диодный лазер в пародонтологии: протокол лечения
В течение 1 недели было назначено три посещения, а четвертое примерно через 30 дней.
Пародонтальные карманы промывали перекисью водорода (3%/10 мл) с помощью одноразового шприца с тупой иглой. Сочетание фотодинамической терапии и перекиси водорода, по-видимому, усиливает бактерицидный эффект, приводя к значительному уменьшению колоний бактерий, таких как Prevotella intermedia, Peptostreptococcus micros и Fusobacterium nucleatum.
Неактивное оптическое волокно (диодный лазер 0,320 мм/808 нм или диодный лазер 0,400 мм/980 нм) вводили в каждый карман, чтобы достичь его самой апикальной точки, затем активизировали волокно и медленно подметающими движениями перемещали его в апикокорональном и мезиодистальном направлениях в течение максимум 30 секунд на каждом участке пародонтального кармана.
При таком лечении наконечник оптического волокна был направлен к внутренней стенке карманов, где находятся наиболее патогенные бактерии, и к корневой поверхности, которая «заражена» бактериальными эндотоксинами.
Лазерная пародонтальная санация сопровождалась биостимуляцией с использованием специального наконечника, характеризующегося расфокусированным лучом. Обработка проводилась в течение 60 сек при 0,7 Вт непрерывной волной. Наконечник всегда находился в медленном движении, рисуя небольшие круги и соприкасаясь со слизистой оболочкой.
При низкоинтенсивной лазерной терапии световая энергия, излучаемая лазером, вызывает полезные клеточные и биологические реакции. На клеточном уровне метаболизм усиливается, стимулируя выработку аденозинтрифосфата. Эта энергия нормализует функции клеток и содействует заживлению тканей.
Санация карманов всех зубов проводилась без использования местной анестезии или системных антибиотиков.
Поддерживающая пародонтологическая терапия
Пациенты приглашались на прием каждые 3 месяца в течение первого года и каждые 4 месяца в течение последующего 9-летнего периода наблюдения. Пациентам проводился скейлинг по мере необходимости, профилактическое удаление налета, давались надлежащие инструкции по уходу за полостью рта в домашних условиях, подкрепленные индивидуальным подбором средств и предметов гигиены. Один раз в год пациенты из тестовой группы получали лазерное лечение до проведения пародонтальной обработки.
Статистическая оценка
Статистический анализ проводился с помощью программного обеспечения с открытым исходным кодом «OpenEpi» версия 3.03 a. Выводы об этих двух группах были сделаны с использованием t-критерия для независимых данных с 95% точностью. Вероятность ошибки составляла <5%.
Результаты работы
Всего было оценено 646 зубов (433 в тестовой группе и 213 в контрольной группе). Всего в тестовую группу было включено 124 многокорневых и 309 однокорневых зубов, в то время как в контрольную группу были включены 64 многокорневых и 149 однокорневых зубов.
У пациентов из тестовой группы было потеряно 19 зубов (16 многокорневых и 3 однокорневых), из них 13 в течение первого года. У пациентов из контрольной группы было потеряно в общей сложности 30 зубов (19 многокорневых и 11 однокорневых), из них 16 в течение первого года.
Из всех зубов, утраченных в тестовой группе (4,4%), 1% были однокорневыми и 12,8% — многокорневыми.
Из всех зубов, потерянных в контрольной группе (14%), 7% были однокорневыми и 29% — многокорневыми.
Средние значения глубины карманов, клинического уровня прикрепления и степени кровоточивости были измерены в исходном состоянии, через 1 год и 10 лет после лечения. В тестовой группе среднее значение глубины карманов, зарегистрированное до лечения, составило 4,1 мм, что было уменьшено до 2,5 мм и 2,4 мм через 1 год и 10 лет соответственно. Разница между группами была статистически значимой через 1 год (Р =0,014) и через 10 лет (Р <0,001).
В контрольной группе среднее значение глубины карманов до лечения составило 3,4 мм, что было уменьшено до 2,8 мм и 2,7 мм через 1 год (Р =0,014) и 10 лет (Р <0,001) соответственно.
В тестовой группе среднее значение клинического уровня прикрепления, зарегистрированное до лечения составил 4,6 мм, который снизился до 4,1 мм через 1 год и 2,9 мм через 10 лет, причем разница между группами была статистически значимой через 1 год (Р = 0,017) и через 10 лет (Р <0,082).
В контрольной группе среднее значение клинического уровня прикрепления до лечения составило 4,5 мм; через 1 год оно снизилось до 4,4 мм (р = 0,017) и остался на этом уровне через 10 лет (Р <0,082). Средний уровень кровоточивости в тестовой группе до лечения составил 48%, снизился до 15% через год и до 9% через 10 лет.
В контрольной группе значение индекса кровоточивости до лечения было 36%, которое снизилось до 23% через 1год (Р =0,047) и до 14% через 10лет (Р =0,031). Статистическая оценка выявила значительную разницу в диапазоне 1 года (Р =0,047) и 10 лет (Р =0,031).
Карманы с начальной глубиной 6 мм и более
Начальная глубина зондирования карманов для однокорневых зубов у пациентов из тестовой группы снизилась в среднем с 6,7 мм до 3,3 мм через 1 год и до 2,3 мм через 10 лет. Начальная глубина карманов однокорневых зубов у пациентов их контрольной группы снизилась в среднем с 6,4 мм до 4 мм через 12 месяцев и до 3,3 мм через 10 лет.
В тестовой группе глубина зондирования карманов многокорневых зубов снизилась с 6,2 мм до 3,3 мм через 1 год, на этом уровне она оставалась стабильной в течение 10 лет.
В контрольной группе глубина карманов для многокорневых зубов уменьшилась с 7 мм до 5,8 мм через 1 год после лечения и до 5,1 мм через 10 лет.
Среднее увеличение клинического прикрепления у однокорневых зубов в тестовой группе снизилось до 3,8 мм от исходного значения.
Многокорневые зубы в тестовой группе имели среднее увеличение клинического уровня прикрепления на 2,2 мм по сравнению с исходной глубиной зондирования 6 мм и более. Среднее увеличение клинического уровня прикрепления у однокорневых зубов в контрольной группе составило 2,5 мм при исходной глубине зондирования 6 мм и более. Клинический уровень прикрепления у многокорневых зубов в контрольной группе увеличился на 1,9 мм при исходной глубине зондирования 6 мм и более.
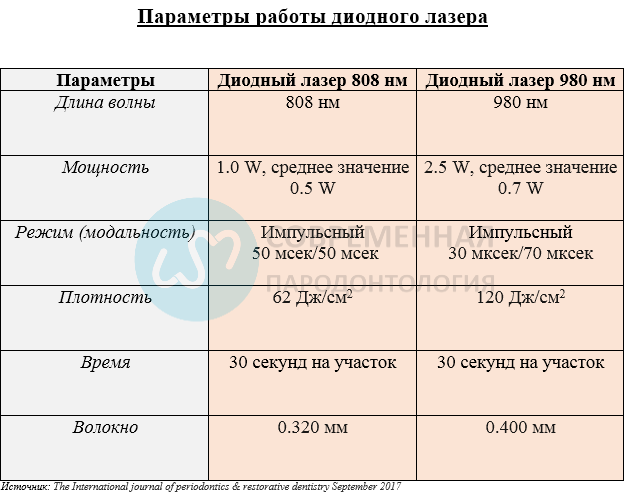
а-глубина кармана около 8 мм при зондировании премоляра на нижней челюсти справа в дистально-щечной области, рецессия 1 мм и потеря прикрепления 9 мм, выражена кровоточивость, b- тот же самый участок через 10 лет, кровоточивость отсутствует, карман -2 мм, рецессия — 1 мм, потеря прикрепления — 3 мм, с- рентгенограмма до начала лечения, d- рентгенограмма через 10 лет.
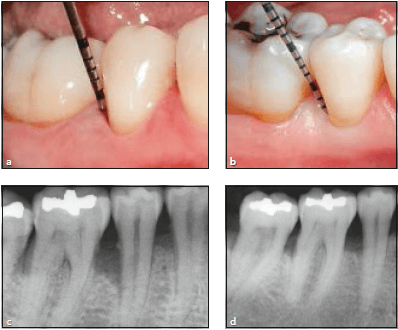
а- клиническая картина до лечения, отмечается глубина кармана 10 мм, гиперплазия десневого края 2 мм, потеря прикрепления 8 мм, b,c — картина через 10 лет, отсутствует кровоточивость, глубина кармана 2 мм, рецессия 2 мм, суммарно потеря прикрепления 4 мм.
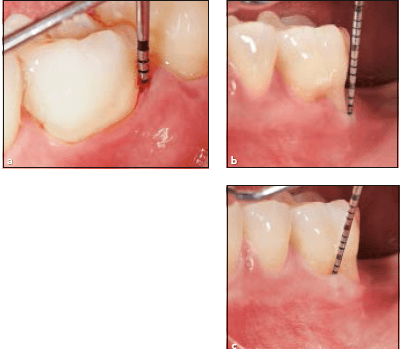
а-картина до лечения правого нижнего латерального резца, глубина зондирования 14 мм, b -тот же участок спустя 10 лет, отмечается глубина зондирования 2 мм, рецессия 3 мм, суммарно потеря прикрепления 5 мм, c — рентгенологическая картина до лечения, d- рентгенологическая картина через 10 лет наблюдения.
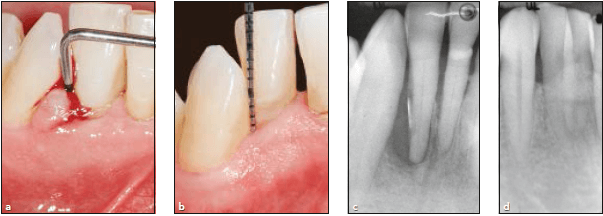
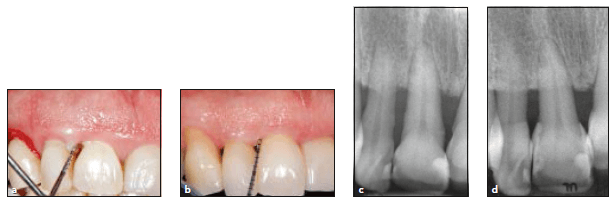
а-клиническая картина до лечения, глубина зондирования 8 мм, рецессия 1 мм, суммарно потеря прикрепления 9 мм, b — клиническая картина через 10 лет наблюдения, глубина зондирования 2 мм , рецессия 1 мм, потеря прикрепления 3 мм, c- рентгенологическая картина до лечения, d- рентгенологическая картина через 10 лет
Обсуждение результатов и предыдущих исследований по данной теме
Величина изменений относительно исходного размера дефекта выражалась их начальной глубиной зондирования (4-5 мм/≥ 6 мм), типом зуба (однокорневой/многокорневой) и средним увеличением клинического прикрепления через 1 год и 10 лет после лечения. Средний прирост клинического прикрепления для однокорневых зубов в тестовой группе составил 1,9 мм от исходной глубины зондирования 4-5 мм и 3,2 мм от исходной глубины зондирования ≥ 6 мм.
Многокорневые зубы в тестовой группе имели среднее увеличение клинического уровня прикрепления на 1,2 мм по сравнению с исходной глубиной 4-5 мм и на 2,6 мм по сравнению с исходной глубиной ≥ 6 мм.
В более раннем исследовании среднее увеличение клинического уровня прикрепления составляло 2,4 мм и 4,9 мм в однокорневых зубах с начальной глубиной зондирования 4- 5 мм и ≥ 6 мм соответственно, в то время как у многокорневых зубов он составлял 1,3 мм и 3,3 мм соответственно.
При исходной глубине зондирования 4-5 мм среднее увеличение клинического уровня прикрепления в однокорневых зубах составило 1,2 мм в тестовой группе и 0,7 мм в контрольной группе.
В предыдущем исследовании для однокорневых дефектов с начальной глубиной зондирования 4- 5 мм нехирургическая пародонтальная терапия достигла среднего снижения глубины зондирования на 1,29 мм, сопровождающегося средним увеличением клинического уровня прикрепления на 0,55 мм.
В многокорневых зубах среднее увеличение клинического уровня прикрепления в настоящем исследовании составило 1,1 мм в тестовой группе и 0,0 в контрольной группе. Для глубины зондирования ≥ 6 мм среднее увеличение клинического уровня прикрепления в однокорневых зубах составило 3,8 мм и 2,5 мм для тестовой группы и контрольной группы соответственно; в многокорневых зубах увеличение клинического уровня прикрепления составило 2,2 и 1,9 мм в тестовой и контрольной группах соответственно.
Большинство исследований, описывающих пределы поддесневого скейлинга были опубликованы до 2000 года; однако с тех пор знания, навыки и методы улучшились. В предыдущем исследовании зубы с начальной глубиной зондирования 7,69 мм имели среднюю поверхность без зубного налета и зубного камня 3,73 мм со стандартным отклонением 0,97 мм. Другое исследование предполагает, что для немолярных зубов не существует пороговой глубины кармана, при которой нехирургическая пародонтальная терапия неэффективна. Эффективность удаления зубного камня и биопленки с поддесневых поверхностей зависит от исходной глубины зондирования, анатомии корня, конструкции инструмента, а также навыков и опыта врача. Опытные пародонтологи оставляют меньше остаточного налета и зубного камня на поддесневых поверхностях корней, чем неопытные стоматологи. Этот фактор, возможно, повлиял на поддесневую обработку в данном исследовании, потому что клиницист был опытным стоматологом.
В соответствии с предыдущим исследованием, использование диодного лазера (810 или 980 нм) в сочетании с классической обработкой корня/кармана, улучшило результаты лечения пациентов со среднетяжелым и тяжелым хроническим пародонтитом. Другие данные показывают, что использование лазерных аппаратов для лечения пародонтита дает минимальную пользу и клиническое применение тепловых диодных лазеров (длина волны 808 и 980 нм) в нехирургической пародонтальной терапии должно быть дополнительно изучено. В некоторых источниках показано, что при использовании в качестве дополнительной терапии, диодный лазер с длиной волны 808 и 980 нм и мощностью от 0,8 до 2,5 Вт обеспечивает хорошие результаты. По сравнению с использованием только SRP, многократное дополнительное применение диодного лазера 980 нм уменьшает глубину зондирования в пародонтальных карманах средне глубины (4-6 мм).
Хирургическое лечение имеет преимущества перед нехирургической терапией глубоких карманов (глубиной 6 и более мм), а также дает больший прирост прикрепления после операции. При умеренной глубине зондирования наблюдается значительно большее увеличение прикрепления после нехирургической терапии по сравнению с хирургическим лечением.
В предыдущем исследовании при глубине кармана ≥ 7 мм SRP, модифицированный лоскут Видмана и костная хирургия привели к увеличению клинического прикрепления на 9,8%, 14,2% и 9,38% соответственно, а также к снижению глубины кармана на 21,6%, 33,1% и 42,8% соответственно. В этом исследовании костная хирургия приводила к значительно большему снижению глубины кармана, чем SRP. Кроме того, метаанализ не показал значительного снижения глубины кармана при SRP и лоскутной операции. Было рекомендовано использовать хирургические методики при глубине кармана >5,4 мм, в то время как нехирургическая терапия должна использоваться для карманов глубиной от 2,9 до 5,4 мм.
Клинические изменения, возникающие в зоне фуркации после нехирургического пародонтальной терапии, отмечены в ограниченном числе клинических исследований.
Пациенты с тяжелой потерей прикрепления пародонта в анамнезе или агрессивными формами пародонтита должны получать поддерживающую помощь пародонтолога, чтобы предотвратить или свести к минимуму рецидив прогрессирования заболевания. Хроническая природа воспалительных заболеваний пародонта требует от врача регулярной переоценки состояния пациентов для надлежащего пожизненного ведения болезни. Для большинства пациентов с пародонтитом в анамнезе визиты проводятся с интервалом в 3 месяца, как и в первый год наблюдения.
Результаты настоящего исследования являются эффективными для поддержания установленного здоровья десен. В настоящем исследовании было установлено, что периодичность поддерживающей терапии пародонта каждые 4 месяца в течение следующих 10 лет является приемлемой.
В предыдущем исследовании наблюдалось снижение глубины кармана после поддесневой санации в сочетании с соответствующей программой домашнего ухода, направленной на адекватный контроль наддесневой бляшки. Более того, уменьшение глубины зондирования облегчает доступ для последующей обработки и полировки во время поддерживающей фазы лечения пародонта, а также для удаления зубного налета во время самостоятельного выполнения гигиены.
В настоящей серии случаев средний уровень кровоточивости на исходном уровне был выше (48%) в тестовой группе по сравнению с контрольной группой (36%), хотя он более значительно снизился в тестовой группе через 1 год (15%) и 10 лет (9%) по сравнению с контрольной (23% и 14%). Оба метода лечения были эффективны для снижения значений кровоточивости в краткосрочной и долгосрочной перспективе до порога, совместимого с понятием клинического здоровья. В предыдущем исследовании аналогичный протокол лечения был применен при лечении периимплантита, и показатели кровоточивости были снижены более заметно в группе лазеров (с 90,09% до 4,95% через 12 месяцев), чем в контрольной группе (с 87,5% до 59,72% через 12 месяцев).
Выводы
Нехирургическая пародонтальная терапия благотворно влияет на ткани пародонта. Настоящее исследование показывает, что если сравнивать классическую нехирургическую терапию пародонтита с многократным применением диодного лазера с длиной волны 810 или 980 нм в сочетании с обычной обработкой корня/кармана, последнее клинически оправдано в случае среднетяжелого и тяжелого хронического пародонтита.
Все пациенты показали удовлетворительное заживление после лазерной нехирургической пародонтальной терапии. Снижение глубины кармана и повышение клинического уровня прикрепления происходило преимущественно в группе пациентов с высоким уровнем гигиены полости рта, которые следовали программе поддерживающей терапии. На основании этих наблюдений можно сделать вывод, что включение диодного лазера в первую фазу нехирургической пародонтальной терапии имеет клиническое значение.
Материал подготовлен с использованием статьи Marisa Roncati, Paolo Vescovi, Annalisa Gariffo «Ten-Year Nonsurgical Periodontal Treatment Protocol with Adjunctive Use of Diode Laser Monitoring Clinical Outcomes in ≥ 6 mm Pockets: ARetrospective Controlled Case Series», ссылки находятся в оригинальной статье.
