Биопленка как и весь микробиом ротовой полости разнообразна. Она существует как структурно и функционально организованное сообщество микроорганизмов на поверхностях полости рта.
Целью данной работы явилась попытка описать сеть микробных взаимодействий (как синергетических так и антагонистических), имеющуюся в биопленках и оценить их роль в поддержании здоровья полости рта и при стоматологических заболеваниях.
В базе данных PubMed проводились исследования по изучению микробных экологических взаимодействий в зубных биопленках. Результаты поиска не поддавались системному обзору и были обобщены в описательном анализе.
Было идентифицировано 547 оригинальных научных статей и 212 обзоров. Большинство (86%) исследовательских статей касались бактериально-бактериальных взаимодействий, в то время как межбиологические микробные взаимодействия были наименее изученными. Взаимодействия включали физические и питательные синергические ассоциации, антагонизм, связь между клетками и перенос генов. Микробные сообщества в ротовой полости проявляются в неожиданно возникающих свойствах, которые не могут быть выведены из исследования одного вида.
Отдельные организмы растут в средах, которые они не смогли бы переносить в естественной среде. Сети множественных синергических и антагонистических взаимодействий создают микробные взаимозависимости и дают биопленкам устойчивость к незначительным изменениям окружающей среды, и это способствует здоровью полости рта. Если ключевые экологические нагрузки превышают пороговые значения, связанные со здоровьем, тогда возрастает конкурентоспособность среди микроорганизмов полости рта и может произойти дисбаланс, что увеличивает риск стоматологических заболеваний.
Биопленка покрывает большую часть поверхностей полости рта. Известно, что ротовая полость поддерживает рост различных сообществ микроорганизмов – вирусов, микоплазм, бактерий, архей, грибов и простейших (Уэйд, 2013). Эти сообщества сохраняются на всех поверхностях, как многовидовая биопленка, они же и формируют обитателей микробиома ротовой полости. Биопленка существует в гармонии с хозяином, и обеспечивает важные преимущества, которые поддерживают общее состояние здоровья и благополучия.
Микроорганизмы, находящиеся в этих ротовых биопленках, живут в непосредственной близости друг с другом, что приводит к широкому кругу потенциальных взаимодействий, которые могут быть синергические или антагонистические. Состав микробиома влияет на оральную среду, и изменения в местных условиях могут повлиять на микробные взаимодействия внутри этих сообществ и частично определяют, является ли связь между оральным микробиомом и хозяином симбиотической или потенциально опасной (дисбиотической). Тем самым увеличиается риск таких заболеваний, как кариес или заболевания пародонта.
Наша цель состояла в том, чтобы проанализировать системно литературу о микробных взаимодействиях в биопленках при патологиях и в нормальном состоянии. Однако, стратегия поиска и результаты, приведенные ниже, привели к выводу о том, что эта тема слишком широка для систематического отчета, и поэтому результаты представлены в виде описательного обзора, в котором внимание уделяется основным микробным взаимодействиям в биопленках полости рта, а также экологическим факторам.
Материалы и методы для обзора
Процедура поиска PubMed была выполнена 19.07.2016. Запрос объединил четыре отдельных пункта поиска: «микробиом», включая бактерии, вирусы, археи, грибы, простейшие или микоплазму; «оральные микроогранизмы», включая отдельные оральные ниши; (взаимодействия, в том числе «экологичность», «взаимодействие», «синергия», «запрет», «совпадение», «сообщение», «метаболизм», «питательные вещества», «передача генов»; а также («бляшка», «биопленка», «сообщество» или «консорциум».
Это привело к 3758 просмотрам. Из них 3593 были отфильтрованы на английском языке. После отбора названий и рефератов записи, которые не касались темы, были исключены, оставив 759 статей. Среди них 212 обзоров.
Подавляющее большинство (86%) оригинальных научных статей (N=547) рассматривали бактериальные взаимодействия. Они включали физические (например, совместную агрегацию, совместную адгезию) и питательные синергические взаимодействия, антагонистические взаимодействия, такие как продуцирование бактериоцинов и других ингибирующих веществ, связь между клетками и перенос генов.
Виды бактерий варьировались от первичных колонизаторов до таксонов, связанных с кариесом и заболеваниями пародонта. Только 45 (8,2%) исследований включали грибы, в то время как взаимодействия с вирусами (18 исследований), археями (4 исследования) и простейшими (3 исследования) были наименее изученными. Межвидовые взаимодействия были рассмотрены в 71 исследовании, причем большинство из них фокусировались на Candida albicans и оральных стрептококках.
Из-за большого количества статей и широкого диапазона методов и результатов среди найденных исследований невозможно было сообщить о результатах в виде систематического обзора или мета-анализа. Вместо этого статьи, которые были идентифицированы описанной процедурой поиска, использовались в качестве основы для описательного обзора.
Биопленка и нормальное взаимодействие микроорганизмов в ней
Биопленка формирует тесную физическую связь между микроорганизмами, что неизбежно увеличивает вероятность возникновения взаимодействий. Все они могут быть разделены на синергическими или антагонистическими (Ходзе и соавт. 2009, Хуан и соавт. 2011, Koленбрандер 2011, 2012 Диаз, Гуо и соавт. 2014, Якубовикс 2015 года, Ноббс и Дженкинсон 2015, НГ и соавт. 2016).
Синергия: биопленка, ее строение и механизм физического взаимодействия в ней
Оральные микроорганизмы должны прикрепляться к поверхностям, таким образом они сохраняются во рту и не гибнут при глотании. Доказательства, полученные в основном из лабораторных исследований, свидетельствуют о том, что ранние колонизаторы придерживаются определенных механизмов рецепции. Главным образом, это происходит за счет адгезии к молекулам в биопленках (Ходжи и соавт., 2009). Хотя, в конечном счете, рост микробов является основным фактором увеличения биомассы (Дидж и соавт., 2007).
Микроорганизмы имеют естественную склонность к прилипанию к другим микробам. Этот процесс (со-прилипания – следование «планктонных» клеток за уже прикрепившимися организмами на поверхности) способствует образованию многовидовых биопленок (Коленбрендер, 2011). Помимо прикрепления клетки к поверхности, совместное их действие также способствует микробным взаимодействиям. Это происходит за счет расположения микроорганизмов рядом с физиологически релевантными партнерами, что облегчает пищевое взаимодействие и формирует пищевые цепи, перенос генов и межклеточную сигнализацию.
Существенные изменения в экспрессии генов происходят, когда клетки находятся в непосредственной близости или физическом контакте друг с другом (Райт и соавт. 2013). В этом случае могут возникнуть и функциональные последствия, такие как защита облигатно анаэробных бактерий в аэробных условиях за счет соседних видах, которые либо потребляют кислород (Брэдшоу и соавт. 1994) или кислород- терпимые (Диаз и соавт. 2002).
Candida albicans также могут группироваться со стрептококками полости рта и могут формировать синергетическое партнерства, в котором грибы способствуют образованию биопленки стрептококков, в то время как стрептококки повышают инвазивные свойства грибов рода Candida (Диаз и соавт. 2012, Ху и соавт. 2014). Эти физические и функциональные объединения могут проявляться и в некоторых более сложных многокомпонентных механизмах. Биопленка может создавать условия для формирования в естественных условиях (на живых организмах) таких образований как “кукурузные початки,” “кисти трубок” или «еж-структуры» (Зингл и соавт. 2010, Дидж и соавт. 2014, Марк Уэлш и соавт. 2016).
Биопленка и пищевые взаимодействия в ней
Основными питательными веществами для микроорганизмов полости рта являются протеины хозяина и гликопротеины, которые получаются главным образом со слюной в наддесневой бляшке и/или из жидкости десневой борозды (РГС) для тех, кто находится в поддесневой биопленке (Вэй и соавт. 1999).
Чистые культуры микроорганизмов полости рта растут плохо или вообще не растут на конструктивно сложных субстратах. Белки расщепляются под действием смеси протеаз и пептидаз. В свою очередь катаболизм гликопротеинов (состоящий из цепи белка, соединенного боковыми цепями с олигосахаридами) предполагает последовательное удаление терминальных сахаров из боковых цепей до того момента, как белковая цепь становится доступной для протеолитической атаки (Такахаси 2015).
Бактерии полости рта экспрессируют гликозидазы с различной спецификой, так что согласованные действия нескольких видов необходимы, чтобы завершить распад гликопротеинов хозяина (Брэдшоу и соавт. 1994). Аналогично, комбинации Streptococcus mutans, Streptococcus oralis and Fusobacterium nucleatum разрушают альбумин более эффективно, чем любой из трех видов по отдельности (Гомер и Бейтоне 1992).
Биопленка с ее матрицей является еще одним потенциальным источником углерода и энергии для взаимодействия группы бактерий полости рта. Растворимые углеводы в зубном налете могут быть метаболизированы только группой бактерий, которые производят экзо — и/или эндо- гидролитические ферменты (Бержерон и Берн 2001, Коо и соавт. 2013). Отдельные бактерии, поэтому, зависят от обмена веществ других видов.
Дальнейшие сложные пищевые взаимосвязи развиваются в микробных сообществах, когда продукты обмена веществ одного организма, основного потребителя (кормильца), становится основным источником питательных веществ для другого (второго потребителя).
Эти пищевые цепи могут привести к полному и энергетически эффективному катаболизму сложных молекул хозяина до простейших конечных продуктов обмена веществ (например, СО2,СН,Н2С).
Многочисленные синергетические метаболические взаимодействия происходят среди бактерий в поддесневой биопленке для того, чтобы позволить им переработать протеины хозяина и гликопротеины в качестве источников питательных веществ (Штеге и соавт. 1987, Штеге и Ван дер Хоу-вэн 1989).
Эти взаимодействия будут обсуждаться более подробно далее в разделе “экологические возбудители дисбактериоза и заболеваний”.
Пищевые взаимозависимости, такие как те, что описаны выше нуждаются в стабильности и устойчивости микробных сообществ полости рта. Результатом зависимости бактерий ротовой полости от метаболизма других порой является то, что этих субстратов является то, что некоторые виды избегают прямой конкуренции по отдельным питательным веществам. Это значит, что они могут сосуществовать и поддерживать стабильное равновесие, формируя так называемый микробный гомеостаз (Александр 1971, Марш 1989).
Это было наглядно продемонстрировано в одном из компьютерных исследований. Было показано 11 бактерий полости рта, которые так взаимодействуют между собой (Мазумдар и соавт. 2013).
Обмен веществ является главным фактором в этом взаимодействии, движущей целью колонизации. Выделены конкретные метаболические пути, связанные с различными слоями биопленки. Результатом явилось возникновение функционально структурированного сообщества. Однако, в таких структурированных сообществах существовал и оптимальный компромисс в совместном использовании ресурсов, так называемый функциональный синергизм (Мазумдар и соавт. 2013).
Примеры пищевых взаимодействий среди микроорганизмов полости рта
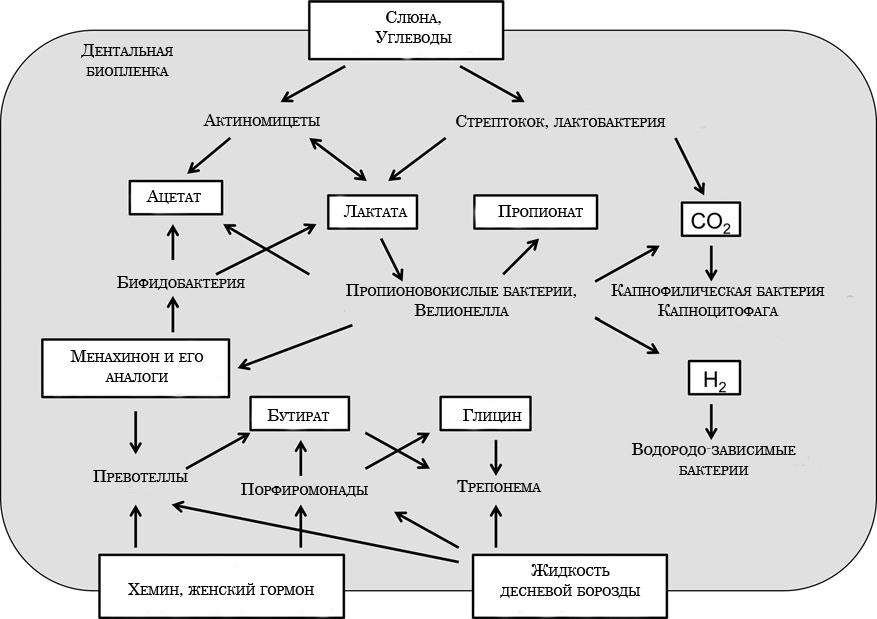
Межклеточное сигнальное взамодействие в биопленке
Биопленка дает возможность для «общения» микробных клеток. Мало того, они могут отвечать на запросы друг друга. Данное «общение» происходит при помощи небольших, диффузных, эффекторных молекул.
Грамположительные клетки вырабатывают пептиды, которые, как правило, имеют узкий спектр действия. В Streptococcus mutans два пептида [компетентностно-стимулирующий пептид (КСП) и Сигма Х- индуцирующий пептид] обеспечивают генетическую компетенцию в других клетках Streptococcus mutans. На выработку этих пептидов влияет местная рН (Гуо и соавт. 2014) и источник углеводов (Мойе и соавт. 2014). Функция КСП — это изменение транскрипции генов и синтеза белка, участвующего в формировании биопленки, развитие компетентности, синтез бактериоцинов, стрессоустойчивость, а также аутолиз (Сенадхира и Квидкович, 2008, Гуо и соавт. 2014).
Некоторые стрептококки могут инактивировать КСП и тем самым препятствовать образованию биопленки (Ванг и соавт. 2011).
КСП производимый С. gordonii также может ингибировать образование биопленки C.albicans (Джек и соавт. 2015).
Вполне возможно, что такая сложная сеть сигнальных взаимодействий будет существовать и в многовидовых биопленках, таких как зубной налет.
Autoinducer-2 (АI-2) производится несколькими видами грам-положительных и грам-отрицательных бактерий ротовой полости и может стать “универсальным языком” для межвидовой и межклассовой коммуникации в царстве зубной биопленки. Эффективность сигналов может быть повышена за счет совместного их соединения.
Формирование биопленки с двумя соседствующими видами S. oralis и Actinomyces naeslundii тормозилось, когда появлялся АI-2 другого типа микроорганизмов (Рикард и соавт. 2006). В то же время АI-2 производимый Aggregatibacter actinomycetemcomitans тормозил формирование биопленки грибами (Бачтиар и соавт. 2014).
AI2, производимый F. nucleatum, имел дифференциальное воздействие на формирование биопленки при культивировании с двумя разными видами стрептококков полости рта; формирование биопленки была повышено с S. gordonii, но уменьшается с S. oralis (Янг и соавт. 2013).
Некоторые из этих ответов зависят от концентрации сигнальных молекул. Эти межклеточные стратегии сигнализации могут заставлять клетки понимать и адаптироваться к различным экологическим стрессам и, тем самым, регулировать (и координировать) экспрессию генов, которая влияет на способность микроорганизмов вызывать заболевание.
Перенос генов в биопленке
Биопленка, как говорилось выше, создает идеальные условия для тесной близости клеток. Она обеспечивает отличные условия для горизонтального переноса генов (ГПГ). ГПГ включает в себя либо приобретение ДНК от совместно проживающих видов или от экзогенных источников (Петерсен и др. 2005, Робертс и Крэфф 2014).
ДНК может передаваться через: трансдукцию с помощью бактериальных вирусов (бактериофагов), конъюгации бактериальных пилей и трансформацию поглощенных ДНК включая, естественно, компетентные бактерии. В дополнении к механизмам выше, ДНК может также быть передана через мембраны везикул в грам-отрицательных бактериях (Олсен и др. 2013). ГПГ позволяет бактериям ротовой полости брать образец из огромного метагенома и, таким образом, повышать свои адаптационные возможности к изменениям в ротовой среде (Робертс и Крэф 2014). Например, метаболическая адаптация к углеводно- насыщенным средам, таких как полость рта и кишечник была обнаружена в штамме Salivarius Lactobacillus, несущих плазмиду с генами, вовлеченных в гликолиз (Робертс и Креф 2014).
ГПГ считается основным механизмом приобретения генов антибиотикорезистентности (АРГ), которые обильно присутствуют в полости рта (Сукумар и соавт. 2016)
Как описано ранее, сигнальные молекулы, такие как CSP, заметно повышают способность клеток реципиента брать ДНК (Синадхира и Квиткович, 2008). Внеклеточная ДНК (в-ДНК) является компонентом матрицы биопленки и играет важную роль в адгезии и хранении питательных веществ и выступает в роли потенциального источника фосфатов и других ионов (Якубович и Берджесс 2015). Образование в-ДНК было продемонстрировано в двойном эксперименте с S. mutans и S.gordonii через производство компетентностно- индуцированного бактериоцина S. mutans (Крэф и соавт. 2005).
Грам- отрицательные бактерии также производят ДНК, включая Veillonella spp. (Ханнан и соавт.2010).
Доказательства ГПГ в биопленках полости рта пришли с открытием, что оба резидента (S. mitis, S. oralis) и патогенные (S. pneumoniae) бактерии, выделенные из носоглоточной области обладают генами, обеспечивающими устойчивость к пенициллину, которые отображают общую мозаичную структуру (Чи соавт. 2007). Схожие свидетельства наводят на мысль обмена генами пенициллин-связывающих белков среди резидентов полости рта и патогенетическими видами Neisseria (Боулэ и соавт. 1994), и генами Iga — протеаз, имеющихся у ряда стрептококков ротовой полости (Поульсен и соавт. 1998).
Антагонистическое взаимодействия в биопленке
Биопленка также содержит и антагонистическое взаимодействие в своем составе. Значительное число исследований, адресованное этой теме, описано с участием межвидовой и межклассовой конкуренции и “войны”.
Производство антагонистических производных, таких как бактериоцины, перекись водорода, органических кислот, различных ферментов и высвобождение литических фагов являются примерами “оружия”, которое может дать микроорганизму конкурентное преимущество во время колонизации и в конкурентной борьбе с другими микробами.
Бактериоцины и бактериоцин-подобные вещества производятся как грамположительными, так и грамотрицательными бактериями. Наиболее изученными видами стрептококков являются S.mutans с выделяемым им мутацином (Меррит и Ци 2012), S. sanguinis и сангуцин, а также S. salivarius и саливарицин (Якубович и соавт. 2014).
Были обнаружены два типа мутацина, обладающие широким спектром действия и имеющие очень узкий антимикробный спектр (Меррит & Ци 2012). Молочнокислые бактерии также вырабатывают бактериоцины и оцениваются как потенциальные пробиотики полости рта во многом благодаря своим противомикробным свойствам; например, реутерин из Lactobacillus reuteri был активен против некоторых пародонтопатогенов и кариесогенных бактерий (Кан и соавт. 2011).
Бактериальная “война” подразумевает, что один из взаимодействующих партнеров подходит за счет других. Это было показано на примере двух таксонов, занимающих одну и ту же нишу – S. gordoniine — Porphyromonas gingivalis и F. nucleatum — S.mutans (Али Мухаммед и соавт. 2013), где S. gordoniine имеет конкурентное преимущество по сравнению S. mutans при использовании аминосахаров из слюнных гликопротеидов в качестве источника энергии: S. gordonii высвобождает перекись водорода, которая ингибирует транскрипцию генов S.mutans, ответственных за метаболизм этих соединений (Цзэн и соавт. 2016).
Действительно, перекись водорода является одним из наиболее изученных реагентов в оральных биопленках, но ее воздействие на ротовую микробиоту носит сложный характер и с трудом поддается прогнозированию. В аэробных условиях (как это может произойти на ранних стадиях формирования биопленки), стрептококки крови производят высокие концентрации пероксида водорода, которые способны ингибировать широкий спектр грамположительных видов (Холмберг и Халандер 1972,1973, Крэф и соавт. 2016). Значительно меньшие концентрации создаются в процессе анаэробного роста. Streptococcus mutans чувствителен к перекиси водорода, но штаммы, которые производят мутацин способны подавлять другие стрептококки (Райан и Клейнберг 1995, Эшби и соавт. 2009). Производство перекиси водорода было предложено в качестве основного механизма для контроля уровня бактерий в зубном налете (Хиллман и соавт. 1985, Хиллман и Шиверс 1988). Однако, другие бактерии в наддесневой биопленке (например вида Neisseria, Haemophilus and Actinomyces) также могут разлагать перекись водорода, и немного свободной перекиси можно обнаружить в зубном налете (Райан и Клейнберг 1995). Таким образом, могут быть различные концентрации пероксида водорода в различных зонах биопленки, и баланс между симбиозом и дисбактериозом может зависеть от сложного взаимодействия между несколькими антагонистическими микробными взаимодействиями.
Антагонистические взаимодействия также могут быть полезными для обоих партнеров и могут даже стимулировать «тренировку» микробного сообщества (Стейси и соавт. 2014).
В присутствии кислорода, А. actinomycetemcomitans, которые питаются лактатом производимым S. gordonii, выживают в высоких концентрациях пероксида водорода, выделяющегося в S. gordonii . Для уменьшения окислительного стресса, А nomycetemcomitans не только выделяет каталазу (Н2О2-фермента детоксикации), но также реагирует на повышенный Н2О2 индукцией дисперсен Б – фермента, который способствует разрастанию биопленки А. actinomycetemcomitans. Это приводит к увеличению расстояния между А. actinomycetemcomitans и Н2О2- продуцирующих S. gordonii.
С другой стороны, S. gordonii, который не производит своей собственной каталазы, является перекрестно защищенным А. actinomycetemcmitans от самозапущенного окислительного стресса.
Разнообразный генофонд бактериофагов ротовой полости был обнаружен с использованием подхода метагеномики (Прайд и соавт. 2012, Наиду и соавт. 2014, Далмассо и соавт. 2015, Эдлунд и соавт. 2015 года). Фаги являются бактериальными вирусами, которые могут лизировать конкурирующие клетки.
Производство антагонистических факторов не обязательно приведет к полному уничтожению чувствительных видов. Из-за наличия различных микросред, биопленка позволяет бактериям выживать в условиях, которые были бы несовместимы с ними в однородной среде. Следует отметить, хотя паразитические по своей природе, фаги могут иметь полезную роль в ротовой экосистемы, недавнее сравнение сети (колонии) бактериофагов показало, что фаги поддерживают комплекс структуры микробного сообщества в здоровом состоянии, которая отсутствовала во время пародонтита (Ванг и соавт. 2016).
Антагонизмом будет также считаться механизм, посредством которого экзогенным видам невозможно колонизировать ротовую полость. Было показано, что стрептококки ротовой полости мешают колонизации синегнойной палочки через нитрит-опосредованного вмешательства (Скофилд и Бай 2015, 2016).
Более сложная структура колонизационной резистентности была описана в лабораторных условиях. Было изучено микробное сообщество полости рта мыши. Оказалось, что Streptococcus saprophyticus, посылая вторгшемуся штамму Escherichia coli (кишечной палочки) сигналы, также получал диффузные сигналы от “посредника” (Streptococcus infantis). Все это в результате подавляло способность “убийцы” (гемолитического стрептококка) выделять перекись водорода (Хи и соавт. 2014), которая должны была подавить чужеродный микроб.
Модель взаимодействия Sreptococcus gordonii и Aggregatibacter actinomycetemcomitans : производство перекиси водорода S. gordonii (Sg) поддерживает потребление лактата А. actinomycetemcomitans (АА)
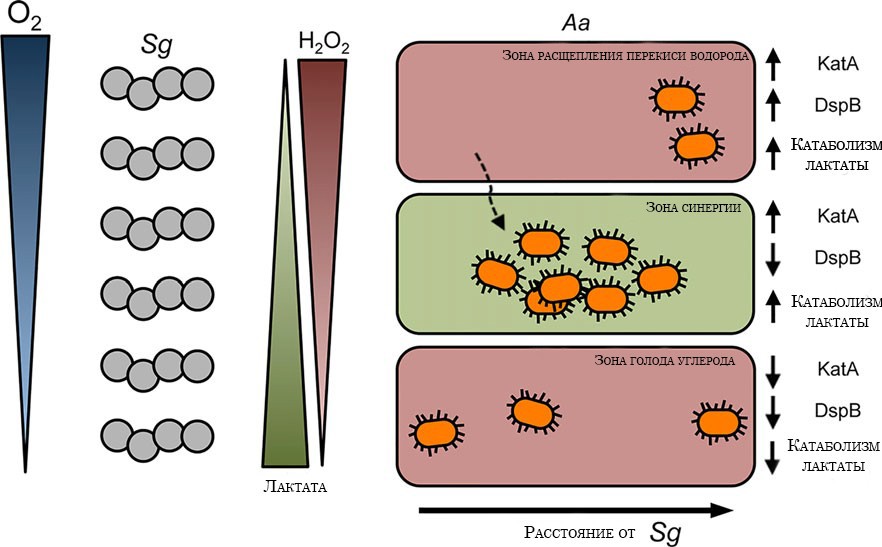
Экологические возбудители дисбактериоза и болезней полости рта
Биопленка очень чувствительная к внешним изменениям. Когда происходят изменения окружающей среды в ротовой полости, это влияет и на экосистему. Это оказывает влияние на результат взаимодействия микроорганизмов в биопленках, которые будут влияют на количество членов сообщества, и может увеличить риск заболевания (дисбиоза).
Рассмотрим два варианта сценария ниже: один из них ведет к кариесогенной, а другой к пародонтопатогенной ситуации.
Возникновение кариеса зубов связывают с увеличением частоты потребление пищевого сахара. Эти сахара быстро метаболизируются в кислоты (преимущественно молочную кислоту), а биопленка в свою очередь создает и низкий уровень pH.
Лактат может быть использован вейлонелой, нейссерией (Хосино и Арайя 1980), гемофильной палочкой (Тродт и Клейнберг 1996), и актиномицетами (Такахаси и Ямада 1996), с образованием более слабых кислот.
Меньшее количество кариозных поражений и меньше лактата в зубном налете были установлены у крыс, инфицированных S. mutans и Veillonella alcalescens, чем у животных, инфицированных только S. mutans (Ван дер Хувен и соавт. 1978).
Большое количествово Veillonella spp. были обнаружены в пробах из очагов поражения кариесом по сравнению с налетом здоровой эмали (Брутто и соавт. 2012), возможно, из- за повышенной гликолитической активности и более высокого уровня лактата на этих местах(очагах). Симбиоз Veillonella и S.mutans был продемонстрирован в смешанных культурах: когда Veil-lonella parvula была добавлена в пары антагонистов (S. mutans and S. gordonii), он смягчается угнетающее воздействие S.gordonii на метаболизм сахара и рост S.mutans (Лю и соавт. 2011).
Биопленка с низким уровнем PH,как правило связана с кариесом , и не ингибирует рост многих бактерий, что приводит к снижению микробного разнообразия (Брутто и соавт. 2012, Цзян и соавт. 2011, Ли и соавт. 2007, Петерсон и соавт. 2013). Повторяющиеся условия с низким рН изменяют конкурентоспособность членов сообщества биопленки. Увеличивается доля кислотообразующих и кислотно- терпимых бактерий, включая mutans streptococci, lactobacilli (Брэдшоу и соавт. 1989). Сахароза-индуцированный дисбактериоз влечет за собой не только снижение таксономического разнообразия. В изменившейся среде белки вовлекаются в перенос и выработку кислот (Рудни и соавт. 2015).
Механизмом борьбы против подкисления экосистем является производство щелочи членами сообщества, в основном за счет производства аммиака из аргинина и мочевины (Берн, 2000, Шу и соавт. 2003, Лю и соавт. 2012, Хуан и соавт. 2015, Такахаши 2015).
Недавно было обнаружено гораздо большее разнообразие щелочно-генерирующих бактерий в сложных биопленках полости рта чем считалось ранее. В том числе были идентифицированы следующие ферментные системы глутамат-дегидрогеназы, тиронин и серин-дезаминаза. Также была отмечена повышенная экспрессия белков, участвующих кроме этого и в образовании газообразного аммиака, активность уреазы (Эдлунда и соавт. 2015).
Кроме того, это исследование показало, что виды Veillonella хорошо приспособлены к кислотному стрессу. Они имеют различные способы регуляции, восстанавливающие уровень рН.
Таким образом, в отличие от здорового состояния организма, возникновение кариеса зубов связывают с изменением в строении сообщества биопленки, в котором преобладают расщепляющие сахар и кислотно-терпимые микроорганизмы, приводящие к потере разнообразия микроорганизмов, а также снижению уровней и активности полезных бактерий (Брутто и соавт. 2012, Цзян и соавт. 2011, Ли и соавт. 2007, Петерсон и соавт. 2013). Отмечено также появление разнообразия бактерий при поражении дентина (Симон Соро и соавт. 2014).
Напротив, накопление микробной биомассы вокруг десневого края вызывает воспалительную реакцию. Это приводит к увеличению расхода фактора роста (РГС), который обеспечивает тот факт, что не только компоненты защиты (например, систему комплемента, иммуноглобулины, нейтрофилы, цитокины) (Эберсоул 2003), но и молекулы владельца (хозяина), могут выступать в качестве субстратов для протеолитических бактерий. Некоторые из эти молекул содержат также гемин (например, гаптоглобин, гемопексин, гемоглобин), который является важным фактором для роста потенциального пародонтопатогенов таких как P.gingivalis (Ольчак и соавт. 2005).
Изменения в местных экологических условиях, связанных с воспалением, будет изменять и конкурентоспособность и результат взаимодействия многочисленных факторов среди микробов, составляющих поддесневой микробиоценоз. Таким образом биопленка может существенно изменять свой состав. Хотя есть мнение, что есть серьезные изменения в пропорции отдельных видов в биопленках воспаленных участков (например, См. комментарии Перез-Чапарро и соавт. 2014, Диаз и соавт. 2016), есть и противоречивые сообщения о том, что разнообразие получаемых микробных сообществ изменяется. Разнообразие может увеличиваться при гингивите (Кистлер и соавт. 2013, Шинкаглия и соавт. 2017), но доказательство того, что оно имеется и при хроническом пародонтите является сейчас более спорным (Абуслеми и соавт. 2013, Гонконг и соавт. 2015, Кирст и соавт. 2015, Парк и соавт. 2015).
Воспалительная реакция может оказывать влияние на поддесневую микробиоту двумя способами: (I) через влияние на защитников хозяина и (II) в результате изменения окружающей среды.
Врожденная защита будет препятствовать некоторым восприимчивым видам, но количество пародонтальных патогенов, таких как P. gingivalis , может серьезным образом подорвать реакцию хозяина, например, путем деградации комплемента, нарушающих функции нейтрофилов и блокирование фагоцитоза (Слейни и Кертис 2008, Хайшенгализ и Ламонт 2014, Мысак и соавт. 2014). Таким образом, чувствительные виды будут уничтожены (хотя некоторые могут выжить благодаря защите соседних организмов), а те, которые могут выдерживать воспалительную реакцию будут процветать.
Есть мнение, что микробные сообщества, которые связаны с пародонтитом являются «любителями воспаления» в том, что они приспособились не только выносить воспалительный процесс, но и воспользоваться изменившимися условиями окружающей среды (Хайшенгалис, 2014), такими как небольшие подъемы рН и температуры (Эггерт и соавт. 1991, Феди и Killoy 1992, Хаффаe и соавт. 1992, Нуако и соавт. 2005). Такие небольшие изменения в местной среде могут изменять экспрессию генов и повышают конкурентоспособность видов, таких как P. gingivalis P. в микробных сообществах (Марш и соавт. 1993).
Однако, более существенным для структуры пародонтального кармана является измененное состояние питательных веществ в результате увеличение потока десневой жидкости. Для изучения этого влияния были проведены лабораторные исследования с использованием сыворотки в качестве суррогата десневой жидкости. При этом наблюдалось сложное взаимодействие в цепочки питания микробных поддесневых сообществ (Штеге и соавт. 1987, тер Штеге и Ван дер Хоу-вэн 1989).
Биопленка пациентов с хроническим пародонтитом претерпела существенные изменения при контакте с предварительно обработанной сывороткой крои. Состав микробных сообществ существенно изменился.
Изначально, цепи углевода были удалены микробами организмами при помощи фермента глюкозидазы. За этим последовал гидролиз ядра белка облигатными анаэробными бактериями, которые привели к массовому аминокислому брожению. Важно отметить, что отдельных виды микроорганизмов очень плохо растут только в чистой культуре на сыворотке (Штеге и Ван дер Хувен 1989).
Многочисленные пищевые взаимозависимости и физические взаимодействия будут развиваться среди видов справляющихся с множеством новых факторов хозяина, возникающих во время развития воспалительной реакции. Например, сложная, симбиотическая связь была продемонстрирована в лабораторных исследованиях P. gingivalis и Treponema denticola (Грениер, 1992, Тан, 2014). Ранние исследования показали, что изомасляная кислота, продуцируемая P. gingivalis, стимулирует рост T. denticola, тогда как сукцининовая кислота, вырабатываемая T. denticola, усиливает рост P. gingivalis (Грениер,1992). Более поздние исследования показали, что биомасса выше, когда оба вида выращиваются в совместной культуре, а глицин, продуцируемый P. gingivalis, используется спирохатетом (Тан, 2014). Оба вида реагируют на присутствие других, как видно из изменений в экспрессии гена у обоих видов. Аналогичным образом, рост некоторых видов, ранее описанных как «некультурный» (например, Fretibacterium fastidiosum, Prevotella HOT-376, Tannerella HOT-286), был обусловлен их зависимостью от сидерофоров и к близкой физической близости «хелперных» штаммов.
Другие исследования продемонстрировали важность тесных физических ассоциаций при взаимодействии некоторых видов грамотрицательных анаэробных бактерий (Шарма и др. 2005, Окуда и соавт. 2012).
Заболевания пародонта могут быть примером «патогенного синергизма», в котором заболевание является следствием комбинированной активности взаимодействующего сообщества, в котором каждый член является только слабо вирулентным. Различные режимы будут играть определенную роль или функцию, чтобы сообщество сохранялось и вызывало болезни. Это согласуется с недавней концепцией видов с низким содержанием («краеугольные болезнетворные микроорганизмы»), которые имеют диспропорциональный эффект от вирулентности всего сообщества (Ламонт, 2012). Передача генов может происходить в этих сообществах. Это может включать не только мобильные элементы, которые кодируют резистентность к лекарственным средствам, но также и большие участки ДНК, которые влияют на вирулентность клеток-реципиентов. Например P. gingivalis обладает «островком патогенности» (Куртис, 1999).
Доказательства роли всего сообщества, а не только нескольких патогенных заболеваний при дисбиозе недавно были получены метатранскриптомическим анализом зубных биопленок с мест с активным пародонтальным заболеванием (Йост, 2015).
Различные стрептококки, Veillonella Parvula и Pseudomonas fluorescens, были очень активны в транскрипции предполагаемых факторов вирулентности, кроме пародонтальных патогенов, таких как Tannerella forsythia и P. gingivalis. Гены, которые были перераспределены на этих участках, были связаны с подвижностью клеток, липидом А и биосинтезом пептидогликоза и переносом железа, калия и аминокислот.
Микробные взаимодействия в таких сложных сообществах могут влиять на результаты лечения. Несмотря на то, что они не предлагаются для рутинного использования при пародонтальных болезнях, антибиотики часто используются в качестве дополнительного метода лечения в сочетании с механической обработкой при тяжелых или рецидивирующих заболеваниях (Джепсен, 2016).
Однако следует помнить о том, чтобы, помимо внутривидовой передачи резистентных генов в микробных сообществах, биопленка может обеспечивать и межвидовой тип передачи. К примеру, бактерии, продуцирующие b- лактамазу, могут защищать соседние организмы, которые должны быть восприимчивы к действию препарата (Уолкер и соавт. 1987, Ван Винкельхоф и соавт. 1997 и соавт. 2013).
Были также предприняты попытки использовать антагонистические взаимодействия для решения как пародонтальной болезни, так и кариеса. Для периодонтальной терапии была применена преднамеренной имплантации полезных бактерий для полости рта в обработанный карман (ван Эше 2013, Тойгхел, 2013) или использование простейших, таких как виды Bdellovibrio (Дашиф, Кадуори 2011, Ван Эше, 2011, Лоренс, 2015) или бактериофага (обзор Аллакер и Дуграс 2009).
В то же время для профилактики кариеса применялись различные подходы (например, молоко, йогурт) с пробиотическими бактериями, которые являются антагонистами S. mutans (Кагетти, 2013). Недавний систематический обзор использования пробиотиков при лечении оральных расстройств пришел к выводу о наличии достаточных доказательств для поддержки использования пробиотиков в случае гингивита и пародонтита, но не для кариеса (Грунер, 2016), хотя данная область, в которой требуется больше исследований.
Выводы
Биопленка содержит множество микробных сообществ, которые могут проявлять «появляющиеся свойства». То есть их свойства и возможности становятся больше, чем сумма компонентов, и их характеристики не могут быть выведены из исследований отдельных организмов (Диаз и соавт., 2014). Биопленка как и микробиота полости рта структурно и функционально организована, и можно утверждать, что такие микробные сообщества можно рассматривать как примитивные многоклеточные организмы (Колдвел, 1997, Педросо, 2015). В области здоровья многочисленные взаимодействия способствуют устойчивости экосистемы против экологических проблем (Марш, 1989).
Если определенные ключевые воздействия на окружающую среду превышают пороговые значения, которые варьируются от пациента к пациенту, тогда конкуренция некоторых бактерий изменяется и может возникать дисбактериоз, приводящий к кариесу или заболеваниям пародонта.
При кариесе и пародонтите имеются изменения состояния питательных веществ из-за увеличения ферментируемых углеводов и белков- хозяина (включая молекулы, содержащие гемин). Соответственно, нарушаются и микробные взаимодействия, которые влияют на баланс микробных сообществ и здоровье полости рта.
Эффективное предотвращение стоматологических заболеваний потребуют вмешательства в эти факторы, приводящие к дисбактериозу (Марш, 2003). Если биопленка и ее микробные взаимодействия будут пониматься по другому, то это может привести к изменению стратегии профилактики основных заболеваний.
Текущий поиск литературы привел нас к следующим выводам: (i) оральные микробные взаимодействия относятся к очень изученной и разнообразной теме, которая слишком широка для системного обзора; (ii) большинство оральных микробных взаимодействий были исследованы в лабораторных системах и на животных моделях, и поэтому следует проявлять осторожность при экстраполяции этих результатов на людей; (iii) большинство изученных взаимодействий включают только бактерии, в то время как другие сегменты оральной микробиоты (грибы, археи, вирусы, простейшие) недостаточно изучены; (iv) современные технологические достижения (например, метагеномика, метатрансеномика, метапротеомика, метаболомика, спектральная флуоресценция изображений, in situ гибридизация) позволяют изучать более сложные взаимодействия на уровне сообществ, в том числе среди членов микробиоты из разных групп (Диаз, 2014); (V) как синергические, так и антагонистические взаимодействия способствуют экологической стабильности микробного сообщества, которое характеризует здоровье полости рта; и (vi) больше внимания необходимо сосредоточить на том, что микроорганизмы делают в этих микробных сообществах (Такаши 2015), а не просто каталогизировать, какие из них присутствуют. Биопленка, как оральный микробиом, лучше поддается описанию с точки зрения функции, а не как список отдельных организмов, поскольку данные функции могут не обеспечиваться одними и теми же микробами у разных людей (Ллойд-Прайс и др. 2016).
Перевод статьи «Dental biofilm:ecological interaction in health and disease» P.D.Marsh, Egija Zaura, 6.02.2017 «Clinical Periodontology» выполнен авторами проекта «Современная пародонтология».
