Пробиотики – это живые микроорганизмы, которые используются для лечения и профилактики некоторых заболеваний. В некоторых случаях пробиотики могут использоваться в виде пищевых продуктов (например, йогуртов), пищевых добавок или средств местного воздействия (например, кремов для кожи). Основная идея заключается в том, что некоторые виды бактерии могут препятствовать росту патогенных организмов или выделять вещества, которые способствует здоровью организма хозяина.
По определению ВОЗ «пробиотики-это живые микроорганизмы, которые при введении в определённых количествах приносят пользу здоровью организма хозяина».
Хотя термин «пробиотики» является относительно новым (был введен в 1965 году Lilly и Stillwell), использование полезных видов бактерий для профилактики заболеваний не является новым.
Было обнаружено, что ферментация пищи происходит в результате благотворного действия различных видов микробов. Еще древние римляне использовали ферментированные продукты для лечения некоторых заболеваний, а в древней Азии использовали процесс ферментации для сохранения пищи. Естественным образом ферментированные сливки, встречающиеся в традиционной китайской кухне, содержат по меньшей мере 4 вида энтерококков, которые обладают способностью снижать уровень холестерина и тем самым способны снижать прогрессирование сердечно — сосудистых заболеваний. Более известной ферментированной пищей являются корейские ферментированные овощи (кимчи), в которых ферментация является результатом активности лактобацилл. Кимчи, по-видимому, обеспечивает здоровье желудочно-кишечного тракта, оказывает противораковое и антиоксидантное действие, а также укрепляет иммунную систему.
В целом, есть достаточно много публикаций и исследований, посвященных благотворному воздействию пробиотиков в различных сферах медицины. Однако, было показано, что общая польза для здоровья не является результатом воздействия одного бактериального штамма, а скорее вызвана действием различных бактериальных штаммов, оказывающих различное благотворное воздействие на здоровье.
Возрос интерес к разработке пробиотиков, способствующих общему улучшению здоровья и профилактике или лечению таких заболеваний, как синдром раздраженного кишечника, диарея, вызванная инфекционными заболеваниями или дисбактериозом микробиоты кишечника, и целому ряд других расстройств. Метаанализ эффективности пробиотиков в лечении желудочно-кишечных заболеваний показал общие положительные эффекты; однако наблюдаемые эффекты зависят от типа желудочно-кишечного заболевания и используемых пробиотических штаммов.
Использование пробиотиков в лечении аутоиммунных заболеваний
Было показано, что пробиотики не только эффективны в предотвращении инфекций, но и играют потенциальную роль в разрушении патологических цепей, приводящих к распространенным воспалительным аутоиммунным заболеваниям.
Многие заболевания, такие как диабет 1 типа, ревматоидный артрит и воспалительные заболевания кишечника, связаны с дисбактериозом микробиоты. Однако неясно, вызван ли этот дисбиоз воспалительным аутоиммунным заболеванием, или он уже присутствует и вносит свой вклад в этиологию заболевания.
Диабет 1 типа — это аутоиммунное заболевание, при котором аутореактивные Т — клетки «нацеливаются» на инсулин и проинсулиновые пептиды, продуцируемые бета-клетками поджелудочной железы, что приводит к инсулиновой недостаточности.
Анализ микробиоты у пациентов с сахарным диабетом 1 типа показал снижение как видов лактобацилл, так и бифдобактерий, которые обычно используются в пробиотиках. Кроме того, у пациентов с сахарным диабетом 1 типа наблюдается повышенный уровень бактероидов в кале, который положительно коррелирует с уровнем аутоантител, продуцируемых в этой популяции.
Было показано, что добавление бифдобактерий у пациентов с сахарным диабетом 1 типа оказывает противовоспалительное действие через дифференцировку регуляторных Т-клеток.
Ревматоидный артрит — это аутоиммунное воспалительное заболевание, характеризующееся разрушением хрящевой и костной ткани в суставах в результате чрезмерной стимуляции иммунного ответа повышенным уровнем воспалительных цитокинов, таких как фактор некроза опухоли, интерлейкин-1 и интерлейкин-6.
Как и у пациентов с сахарным диабетом 1 типа, у пациентов с ревматоидным артритом наблюдается снижение уровня бифидобактерий и Bacteriodes fragilis, что приводит к повышению уровня Prevotella copri.
Было показано, что Prevotella copri продуцирует пептиды HLA — DR (Pc-p27), что приводит к дифференцировке клеток Т-хелперов — 1 и, в конечном счете, к прогрессированию заболевания ревматоидным артритом.
Назначение больным ревматоидным артритом Lactobacillus casei и комбинацией L. casei, Lactobacillus acidophilus и Bifidobacterium bifidum показали выраженное снижение активности заболевания и улучшение состояния больных по сравнению с контролем.
Добавление пробиотиков при лечении воспалительных аутоиммунных заболеваний показало многообещающие предварительные результаты; однако необходимы дальнейшие исследования для более полной оценки защитной роли этих микроорганизмов в качестве вспомогательных или профилактических средств.
Пробиотики в профилактике заболеваний пародонта
Интерес к использованию пробиотиков для профилактики пародонтита возник в начале 1990-х годов. Обоснование использования пробиотиков для лечения желудочно-кишечных заболеваний, а также для лечения заболеваний полости рта имеет смысл, поскольку ротовая полость связана с желудочно-кишечным трактом и в некотором смысле они разделяют аналогичную сложную микробиоту.
В настоящее время безрецептурные препараты для укрепления здоровья пародонта доступны в виде пероральных пробиотических средств (например, Periobalance®, Sunstar).
Концепция дополнительного применения пробиотиков при лечении пародонтита подтверждается несколькими исследованиями. Например, одно крупное исследование на животных показало, что введение пробиотических бактерий в пародонтальные карманы после SRP снижает последующую поддесневую реколонизацию пародонтопатогенов. Клинически это выражалось в снижении степени воспаления десен по сравнению с контролем. Эта концепция была названа “подходом управляемой реколонизации” Teughels et al.
Представители семейств Bifidobacteriaceae и Lactobacillaceae являются видами пробиотических бактерий, наиболее широко изученных для использования в стоматологии и медицине. Оба семейства бактерий являются основными компонентами микробиоты ротовой полости человека, а также желудочно-кишечного тракта и мочевыводящих путей.
Бифидобактерии являются грамположительными, неподвижными микроорганизмам, и хотя их классифицируют как анаэробов, они в целом толерантны к кислороду. Бифидобактерии могут влиять на соседние популяции микробов по причине их быстрой скорости пролиферации.
Лактобациллы — грамположительные факультативные анаэробы, имеющие палочковидную форму, неспорообразующие. Lactobacillus reuteri представляет особый интерес из — за своей высокой эффективности в регуляции микробного дисбиоза, улучшении проницаемости кишечника и укреплении здоровья костной ткани.
Несколько штаммов пробиотических бактерий были рекомендованы в качестве кандидатов для дополнительного исследования их способности снижать заболеваемость кариесом зубов и предотвращать или лечить заболевания пародонта.
К ним относятся определенные штаммы лактобацилл и стрептококков, которые проявляют антибактериальную активность в отношении патогенов тканей пародонта, большую адгезию к эпителиальным клеткам полости рта/десен или к пелликуле. У этих микроорганизмов также отсутствует кариогенность и имеется низкий риск развития инфекционного эндокардита.
Например, в одном из исследований 57 человек, принимавших пастилки, содержащие Lactobacillus salivarius в течение 4 или 8 недель, показали снижение колонизации патогенами тканей пародонта, такими как P. gingivalis и Prevotella intermedia.
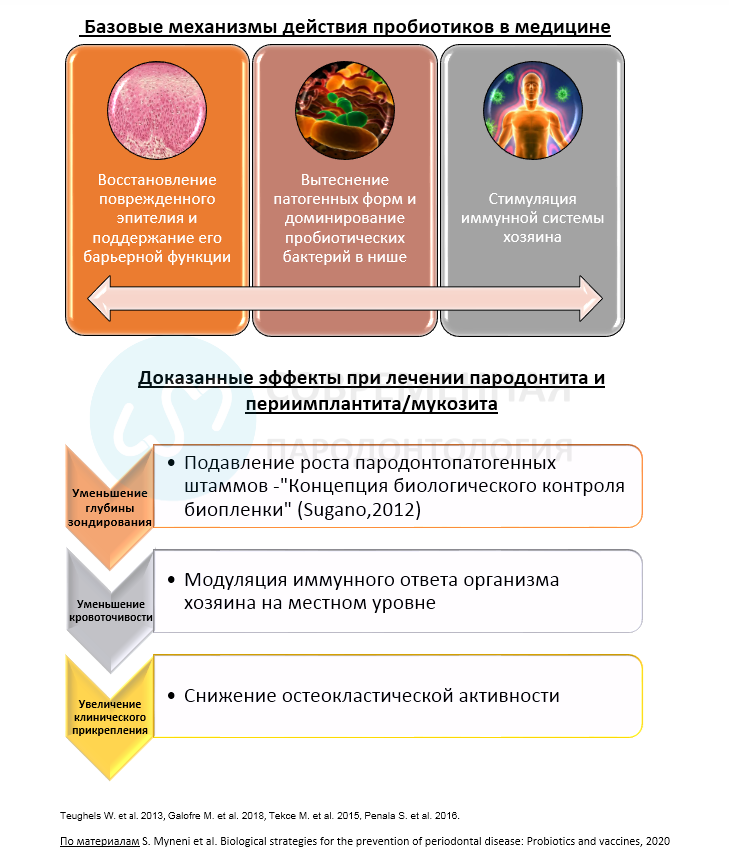
Так как имеется большое количество различных пробиотических штаммов с различной пользой для здоровья в литературе описан ряд общих механизмов действия пробиотиков.
Общий механизм действия пробиотиков
Восстановление и поддержание целостности эпителия
Воспалительные процессы возникают в желудочно-кишечном тракте при повреждении эпителиального барьера, подвергая подслизистую оболочку воздействию микробных и пищевых антигенов. Это проявляется чаще всего при воспалительных заболеваниях кишечника. Многочисленные исследования показали положительное влияние пробиотических бактерий на восстановление этого эпителиального барьера. В одном из исследований было отмечено, что лактобациллы способны регулировать некоторые гены, кодирующие соединительные эпителиальные белки, такие как Е — кадгерин и B — катенин, имеющие решающее значение для эпителиального барьера, разделяющего просвет кишечника и подслизистую оболочку.
Лактобациллы влияют на селективное фосфорилирование этих белков, в то время как штамм Escherichia coli (штамм Nissle 1917), как было показано, понижает регуляцию протеинкиназы С- zeta, которая участвует в повреждении эпителиального барьера, тем самым усиливая сборку и формирование эпителиального барьера после инсульта. По данным исследований in vitro, инкубация либо с лактобациллами, либо со штаммом Escherichia coli Nissle поврежденного эпителиального барьера приводила к репарации и восстановлению функции барьера по сравнению с контролем.
Кроме того, было обнаружено, что специфический штамм лактобацилл Lactococcus lactis ML2018 противодействует провоспалительным эффектам липополисахаридов и предотвращает высвобождение вредных молекул, таких как оксид азота.
Исследования In vivo показали выраженную противовоспалительную активность после приема L. lactis ML2018, уменьшение инфильтрации макрофагов, ингибирование провоспалительных путей и протеинкиназы, а также восстановление эпителиального барьера.
Доминирование пробиотических бактерий
Для того, чтобы пробиотик оказал положительное воздействие на здоровье, живые бактерии должны колонизировать определенный участок и размножаться в достаточно большом количестве, чтобы противостоять патогенам.
Есть несколько характеристик, которыми обладают пробиотические бактерии, чтобы подавлять патогенные микроорганизмы. Наиболее изученным местом действия пробиотиков является желудочно-кишечный тракт, эпителий которого содержит бокаловидные клетки и энтероциты, которые постоянно выделяют муцин и слизь, препятствующие прилипанию патогенов. Было показано, что пробиотические штаммы лактобацилл адгезируют к эпителиальным клеткам и тканям кишечника, используя специальнные белки-адгезины и генетические факторы, такие как MabA (модулятор адгезии). Кроме того, другие виды, такие как Bifidobacterium animalis, имеют белки, которые способствуют адгезии к эпителиальной выстилке путем деградации внеклеточного матрикса, связывания с плазминогеном, а также прямого прикрепления к муцину или коллагену и образования фимбрий.
Локализация и адгезия пробиотических бактерий к участку хозяина является первым шагом в терапевтических преимуществах лечения пробиотиками. Как только пробиотические штаммы колонизируют интересующую область, они начинают выполнять множество действий, которые в результате приводят к лечебному эффекту.
Вирулентность бактерий частично зависит от их способности связываться со специфическими рецепторами на клетках хозяина, а пробиотические бактерии могут подавлять патогены, конкурируя за эти рецепторы.
Многие пробиотические штаммы, например лактобациллы, продуцируют органические кислоты (такие как уксусная и молочная), которые могут ингибировать рост грамположительных бактерий. В частности, Lactobacillus rhamnosus DR20 и L. ацидофилы HN017 продуцируют как молочную кислоту, так и белки, которые действуют синергически, чтобы подавить энтеротоксигенные бактерии, такие как кишечная палочка. Кроме того, было продемонстрировано, что некоторые штаммы лактобацилл способствуют выработке антигенспецифического IgA, который действует против инфекций в кишечнике.
Иммунная стимуляция организма хозяина
Большой объем данных свидетельствует о том, что пробиотические бактерии усиливают иммунный ответ хозяина, что позволяет предположить существование пробиотиков, оказывающих стимулирующее действие на первоначальный ответ хозяина на воспаление.
Было обнаружено, что пробиотические штаммов лактобацилл индуцируют ранние провоспалительные цитокины, такие как интерлейкин-8, фактор некроза опухоли-альфа, интерлейкин-6 и интерлейкин-1 бета, которые впоследствии приводят к усилению активности макрофагов против патогенов.
Также широко известно, что пробиотики могут индуцировать высвобождение дефензинов из клеток хозяина. Дефензины — это небольшие, богатые цистеином катионные белки, которые являются частью врожденного иммунного ответа хозяина на различные патогены, такие как бактерии, грибы и вирусы. Они проявляют свою антибактериальную активность, нарушая и ингибируя биосинтез бактериальной клеточной стенки.
Специфические штаммы пробиотических бактерий могут влиять на различные части иммунной системы хозяина. Например, некоторые пробиотики могут смягчать воспалительные состояния, снижая активацию Т-клеток и повышая экспрессию клеток Т-хелперов. Было показано, что Lactococcus lactis G50 усиливает иммунный ответ Т-хелпера 1-го типа при подавлении реакции Т-хелпера 2-го типа.
В то время как различные пробиотические штаммы могут допускать селективное усиление или подавление определенных эффекторных иммунных реакций (Т-Хелпер 1, Т-Хелпер 2, Т-Хелпер 17 или Т-регуляторный комплекс), усиление какой либо конкретной оси иммунного ответа все еще недостижимо, поскольку один и тот же пробиотический штамм может проявлять активность лишь по некоторым или всем 4 осям иммунного ответа.
Механизм действия в пародонтологии
Применение пробиотиков в полости рта обосновано на основании ранее проведенных исследований по применению пробиотиков в желудочно-кишечном тракте.
Исследования в литературе по желудочно-кишечному тракту показали, что пробиотики способны модифицировать микробиоту, исключать патогены из желудочно-кишечного эпителия, устранять или делать патогены безвредными для хозяина и индуцировать активацию иммунного ответа хозяина для ускорения заживления. Воспалительные заболевания ЖКТ имеют много общего с хроническим пародонтитом, поскольку и то, и другое можно описать как дисбиотические воспалительные заболевания. Следовательно, многие свойства эффективных пробиотических бактериальных штаммов также могут быть применены и при лечении пародонтита; например, адгезионные способности многих пробиотических штаммов могут быть полезны, чтобы закрепиться в полости рта.
Способность пробиотических видов бактерий подавлять патогены также может способствовать более здоровой среде в полости рта. Кроме того, были изучены другие механизмы действия пробиотиков, объясняющие их действие в качестве дополнения к лечению пародонта.
Исследование in vitro изучило антимикробную активность различных штаммов лактобацилл против предполагаемых патогенов пародонта, таких как Aggregatibactor actinomycetemcomitans, P. gingivalis и Fusobacterium nucleatum, и обнаружило, что штаммы A. actinomycetemcomitans сильно ингибируются штаммами Lactobacillus bulgaricus. Было также показано, что штаммы Lactobacillus rhamnosus специфически ингибируют P. gingivalis и F. Nucleatum.
Было показано, что Lactobacillus salivarius обладает бактерицидным действием в отношении P. gingivalis; при совместном культивировании P. gingivalis был полностью устранен в течение 24 часов. Это также наблюдалось клинически, когда пероральное введение L. salivarius вызывало значительное снижение P. gingivalis в поддесневой бляшке, собранной из пародонтальных карманов у 30 человек, наряду с уменьшением глубины зондирования, кровотечения при зондировании и индекса гигиены.
В отдельном исследовании было обнаружено, что пробиотический штамм Lactobacillus johnsonii NBRC 13952 усиливает активацию макрофагов, что приводит к увеличению фагоцитоза A. actinomycetemcomitans и противодействию его активности.
Лактобациллы естественным образом обнаруживаются в полости рта по мере их появления в первые годы жизни, в течение которых созревает микробиота полости рта. Их часто ассоциируют со здоровьем, а не с патогенным состоянием. Используя их в качестве пробиотиков, можно уменьшить количество патогенных бактерий, одновременно способствуя росту этих предположительно полезных бактерий, которые также могут находиться в биопленке.
Эта концепция «биологического контроля биопленки» — использование пробиотиков и вакцин для элиминации патогенных бактерий—была предложена Sugano в 2012 году. Было показано, что лечение перорально вводимыми Lactobacillis gasseri предотвращает или значительно уменьшает рост P. gingivalis, ответственного за быстрое течение пародонтита, на животных моделях. Кроме того, уровень фактора некроза опухоли-альфа и интерлейкина-6 в десневой ткани значительно снизился, в то время как уровень бета-дефензина-3 значительно повысился, что свидетельствует об усилении иммунного ответа хозяина. Было также показано, что пробиотики модулируют иммунный ответ эпителиоцитов десен, инфицированных P. gingivalis. При совместной инкубации пробиотических штаммов с P. gingivalis уровни интерлейкина-1- бета, фактора некроза опухоли-альфа и толл-подобного рецептора — 4 снижались по сравнению с теми, которые наблюдались в эпителиальных клетках десен, инкубированных только с P. gingivalis, в то время как интерлейкин-8 повышался. Интересно, что пробиотические штаммы лучше прикреплялись к эпителию десны именно в присутствии P. gingivalis.
Лечение пробиотиком Lactobacillus brevis CD2 у мышей с индуцированным пародонтитом привило к значительному снижению уровней фактора некроза опухоли-альфа, интерлейкина-1-бета, интерлейкина-6 и интерлейкина-17, а также к увеличению соотношения аэробных и анаэробным бактерий по сравнению с контрольной группой, что свидетельствует о влиянии пробиотического лечения на иммунную систему хозяина и положительном влиянии на микробиоту тканей пародонта.
Было также обнаружено, что остеокластическая активность зависит от перорального приема пробиотиков. У мышей, получавших ортодонтическое лечение и получавших пробиотики (Bacillus subtilis), наблюдалось снижение количества остеокластов (Р < 0,01) по сравнению с контрольной группой (где было только ортодонтическое лечение).
Это подтверждается исследованиями в других областях медицины; при лечении мышей с индуцированным воспалительным остеолизом в сочетании с введением пробиотика L. casei было отмечено подавление течения остеолиза. Было отмечено, что это клиническое наблюдение приводит к снижению количества макрофагов, снижению уровня фактора некроза опухоли-альфа и синтазы оксида азота, а также одновременному повышению уровня противовоспалительных цитокинов, таких как интерлейкин-4 и интерлейкин-10.
Пробиотики также могут снизить риск развития пародонтита, помогая управлять несколькими факторами риска. Остеопороз и диабет рассматриваются как модифицируемые и немодифицируемые факторы риска развития пародонтита соответственно. Крысам с удаленными яичниками, у которых имитировалось постменопаузальное состояние женщин, вызванное снижением выработки эстрогенов, вводились определенные штаммы пробиотиков, например такие как Bifidobacterum longum. В ответ на такое лечение повышалась экспрессия секретируемого белка, богатого цистеином (также известного как остеонектин), а также генов костного морфогенетического белка — 2, что привело к увеличению плотности костной массы.
Введение B. longum в течение 16 недель самкам крыс после удаления яйцеклеток повышало сывороточные уровни остеокальцина и остеобластов, но снижало сывороточные уровни С-концевых телопептидов и остеокластов.
Аналогичные механизмы наблюдаются при использовании L. reuteri для лечения потери костной массы у мышей с диабетом 1 типа, при которой имеется снижение уровня фактора некроза- альфа и Wnt10b, основной усилитель дифференцировки остеобластов, который подавляется при диабете 1 типа, приводя к патологической потере костной ткани.
При использовании пробиотиков для предотвращения потери альвеолярной кости в экспериментальной модели пародонтита у крыс было обнаружено, что введение штаммов Bacillus до и после SRP приводило к уменьшению количества остеокластов и снижению уровня провоспалительных цитокинов. Потеря костной массы и клиническая потеря прикрепления были значительно снижены по сравнению с контрольной группой (Р < 0,05).
Помимо этих преимуществ лечения пробиотиками в экспериментальной модели пародонтита у крыс штаммам B. lactis удалось изменить биопленку с «более анаэробной» на «более аэробную», что в свою очередь соответствует здоровым тканям пародонта. Разумеется, данное лечение было дополнительным и сочеталось с SRP.
Эффективность пробиотиков при лечении пародонтита
Рандомизированные клинические исследования были использованы для проверки эффективности пробиотиков как дополнения к терапии заболеваний пародонта.
Результаты рандомизированного контролируемого клинического исследования с участием 30 пациентов с хроническим пародонтитом, получавших либо SRP плюс пробиотики (L. reuteri), либо SRP плюс плацебо, показали значительное улучшение уровня клинического прикрепления в группе, где были использованы пробиотики по сравнению с контрольной группой через 3 месяца. Кроме того, наблюдалось значительно большее снижение P. gingivalis в группе SRP плюс пробиотики по сравнению с контрольной группой. В другом исследовании 75% пациентов, получавших пробиотик L. reuteri после SRP, показали статистически значимое снижение уровней провоспалительных цитокинов, фактора некроза опухоли-альфа,интерлейкина-1бета и интерлейкина-17 в десневой жидкости, а также таких клинических показателей, как индекс кровоточивости, глубина зондирования и уровень клинического прикрепления, по сравнению с контролем через 2 недели после лечения.
Аналогичное исследование, используя тот же пробиотический штамм в течение 180 дней, показало, что в группе, где SRP сочеталось с пробиотиками, имелись значительно более низкие значения индекса гигиены, индекс кровоточивости при зондировании, глубина зондирования, и потери прикрепления. Кроме того, группа, получившая дополнительное лечение пробиотиками показала снижение уровня матричной металлопротеиназы-8 и повышение уровня тканевого ингибитора металлопротеиназы-1 по крайней мере в течение 180 дней после назначения пробиотических пастилок, используемых дважды в день в течение 21 дня. Как и в исследованиях на животных, дополнительное лечение пробиотиками в рандомизированном клиническом контролируемом исследовании с участием 40 пациентов приводило к более медленной реколонизации облигатных анаэробов по крайней мере в течение первых 180 дней.
Интересно, что исследование с использованием таблеток Prodentis, содержащих L. Reuteri, в качестве единственного метода лечения пациентов с хроническим пародонтитом легкой и средней степени тяжести показало статистически значимое улучшение глубины зондирования, индекса гигиены и кровотечения при зондировании в экспериментальной группе по сравнению с группой, получавшей только плацебо (Р < 0,05). Однако исследование было ограничено небольшим объемом выборки из 20 человек.
Местное применение пробиотиков также было проверено в рандомизированном контролируемом исследовании с участием 32 пациентов, которые подвергались либо SRP с поддесневым введением пробиотиков и использованием пробиотического ополаскивателя течение 15 дней, либо SRP с плацебо. Полученные результаты показали статистически значимое уменьшение глубины кармана и уменьшение неприятного запаха изо рта в экспериментальной группе по сравнению с контрольной группой плацебо.
Пробиотики также были протестированы при лечении периимплантита. Тройное слепое рандомизированное клиническое исследование с участием 44 пациентов (22 с мукозитом и 22 с периимплантитом) показало, что введение пробиотических пастилок L. reuteri «Prodentis» один раз в день в течение 30 дней стабилизировало клинические показатели воспаления в течение 90 дней. Уменьшение глубины зондирования на 0,25мм и 0,53мм отмечено в области имплантатов с мукозитом и периимплантитом соответственно. Минимальные межгрупповые различия были обнаружены между группами, где использовались пробиотики и назначалось плацебо для при лечении мукозитов; однако группа пробиотиков сохраняла первоначальное снижение глубины зондирования, в то время как группа плацебо имела большую глубину зондирования при повторном осмотре через 90 дней. Различия в уменьшении глубины зондирования были значительно больше в группе пробиотиков, чем в группе плацебо через 90 дней. Кроме того, группа пробиотиков продемонстрировала четырехкратное снижение зубного налета по сравнению с группой плацебо через 30 дней. Интересно, что в группе пробиотиков количество бактерий было увеличено в течение первых 30 дней после начала терапии с последующим снижением к 90 дню; однако в группе плацебо наблюдалось снижение бактериальной нагрузки сразу после механической обработки, но в дальнейшем бактериальная нагрузка неуклонно увеличивалась к 90 дню.
Будущее профилактики заболеваний пародонта: генетически модифицированные пробиотики
Доказано, что применение пробиотиков является общепринятой и эффективной терапией в профилактике и лечении различных воспалительных, метаболических и аутоиммунных заболеваний. Учитывая их широкий спектр биологической активности и механизмы действия, можно сказать, что в будущем возможности проибиотиков могут быть расширены с помощью генной инженерии.
Генная инженерия пробиотиков открывает потенциал для специфического для патологии производства пробиотиков в качестве векторов для пероральных вакцин. Рекомбинантные пробиотики в качестве векторов для пероральных вакцин обладают преимуществами повышенной безопасности (будучи живой вакциной) и способностью выживать в кишечном тракте (что позволяет обеспечить желаемый эффект вакцины). Исследование с использованием молочнокислых бактерии как вектор для доставки мукозальных вакцин показали эффективность в отношении штаммов Streptococcus pneumoniae и Bacillus anthracis.
В другом исследовании было показано, что молочнокислые бактерии являются эффективными вакцинными векторами для профилактики вирусных инфекций, в частности птичьего гриппа H5NI на мышах. В дополнении к защите от специфических бактериальных и вирусных штаммов рекомбинантные пробиотики могут быть сконструированы таким образом, чтобы обеспечить целенаправленную доставку либо внеклеточных белков, либо цитокинов.
Необходимы дальнейшие исследования, чтобы оценить долгосрочные эффекты рекомбинантных пробиотиков на местном и системном уровнях, а также это позволит понять, как следует правильно использовать и применять свойства пробиотиков в качестве векторов. Применение рекомбинантного пробиотика в качестве вектора для пероральной вакцины против пародонтита требует дальнейшего развития, но является потенциальным методом лечения в будущем.
Материал подготовлен на основе статьи «Biological strategies for the prevention of periodontal disease: Probiotics and vaccines» Srinivas Rao Myneni, Kristen Brocavich, Howard H Wang Department of Periodontology, Stony Brook School of Dental Medicine, Stony Brook University, NY, USA
