Данный материал является продолжением статьи «Костная ткань как живой орган. Часть 1».
Основные функции костной ткани — обеспечение опорно-двигательного аппарата, защита органов и минеральный гомеостаз. Механическое напряжение, местные факторы окружающей среды и системные гормоны влияют на баланс между резорбцией и депонированием костной ткани. Выраженные механические свойства кости обусловливают ее прочность и способность к движению. Кроме того, сложный ряд взаимодействий между клетками, матриксом и сигнальными молекулами поддерживает гомеостаз кальция и фосфора в организме, что также вносит свой вклад в механическую прочность.
Механические свойства
Кость — очень динамичная ткань, способная адаптироваться в зависимости от физиологических потребностей. Таким образом, кость изменяет свои механические характеристики в соответствии с метаболическими и механическими требованиями (Burr et al. 1985; Lerner 2006). Как уже говорилось, кальций и фосфор являются основными минеральными компонентами костной ткани в виде кристаллов гидроксиапатита кальция. Гидроксиапатит регулирует как упругую жесткость, так и прочность кости на разрыв. Механизм адаптации скелета регулируется в основном процессами резорбции и формирования костной ткани, которые в совокупности называются ремоделированием кости. Кость резорбируется остеокластами, после чего остеобласты формируют новую кость (Raisz 2005). С точки зрения ремоделирования костной ткани, предполагается, что остеокласты распознают и «поселяются» в участках скелета с нарушенной механической целостностью, и, оказавшись там, начинают ремоделирование кости, стимулируя образование новой кости, которая имеют необходимую прочность (Parfitt 1995, 2002).
В целом костная ткань отвечает на нагрузку увеличением синтеза матрикса и изменением состава, организации и механических свойств (Hadjidakis & Androulakis 2006). Имеющиеся данные свидетельствуют о том, что то же самое справедливо и кости, которая находится в процессе восстановления. Когда кость испытывает механическую нагрузку, механорецепторы остеокластов получают прямую стимуляцию, что запускает процесс регенерации и восстановления кости в данной области. Кроме того, давление увеличивает экспрессию M-CSF, что усиливает дифференцировку остеокластов в костном мозге (Schepetkin 1997). Остеокласты также косвенно стимулируются остеобластами и хондроцитами, секретирующими простагландины в ответ на механическое давление. ECM также может способствовать восстановлению костной ткани посредством передачи сигналов. Механическая деформация матрикса индуцирует электрические потенциалы, которые стимулируют резорбцию остеокластов.
Прочность кости определяется сочетанием качества, количества и скорости обмена костной ткани. Хорошо известно, что потеря плотности кости, или ее количества, снижает прочность кости и приводит к увеличению частоты переломов. Однако некоторые патологические состояния, характеризующиеся увеличением плотности костной ткани, такие как болезнь Педжета, также связаны со снижением прочности кости и увеличением частоты переломов, поэтому качество кости также является важным фактором в определении ее прочности.
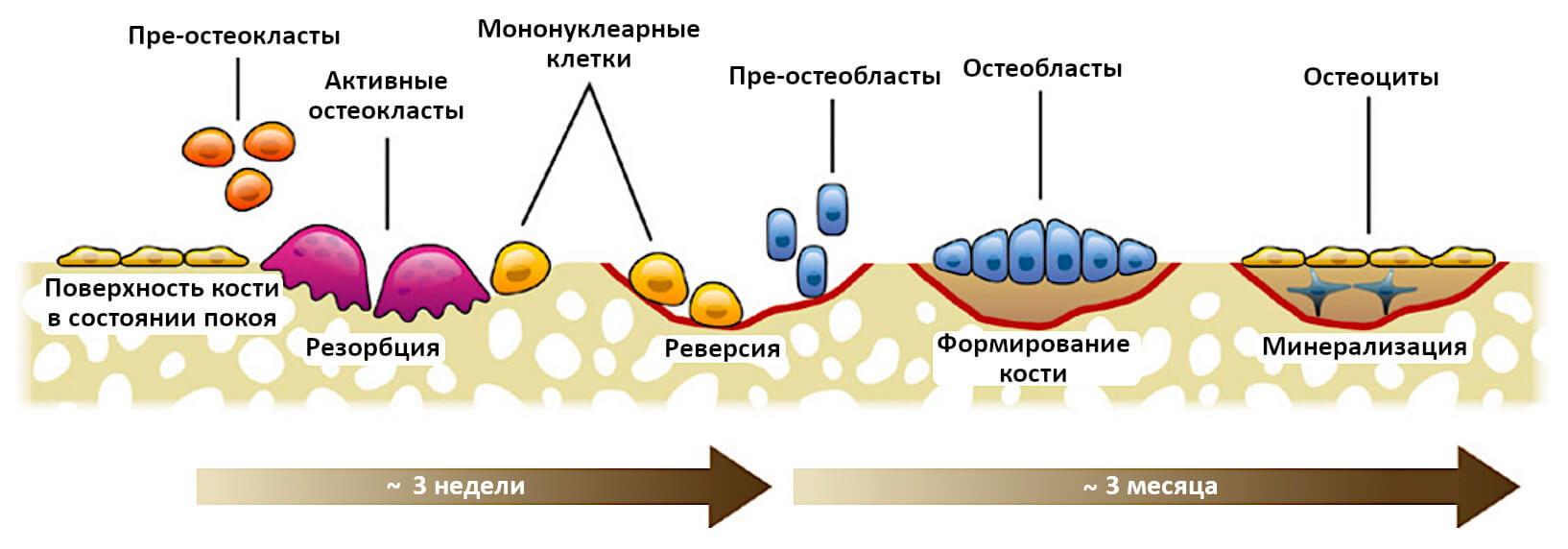
Рис.1. Ремоделирование костной ткани
Цикл ремоделирования включает в себя ряд последовательных этапов, которые в значительной степени регулируются. Фаза «активации» ремоделирования зависит от воздействия местных и системных факторов на мезенхимальные клетки линии остеобластов. Эти клетки взаимодействуют с гемопоэтическими предшественниками, образуя остеокласты в фазе «резорбции». Затем наступает фаза «реверсии», во время которой на поверхности кости присутствуют мононуклеарные клетки. Они могут завершать процесс резорбции и вырабатывать сигналы, инициирующие формирование костной ткани. Наконец, последовательные волны мезенхимальных клеток дифференцируются в функциональные остеобласты, которые формируют матрикс в фазе «формирования»
Метаболические свойства
Гомеостаз кальция имеет большое значение для многих физиологических процессов, поддерживающих здоровье (Bonewald 2002; Harkness & Bonny 2005). Остеобласты откладывают кальций с помощью механизмов, включающих транспорт фосфатов и кальция с подщелачиванием для поглощения кислоты, образующейся при отложении минералов; минерализация хрящевого кальция происходит путем пассивной диффузии и образования фосфатов. Мобилизация кальция остеокластами в свою очередь опосредована секрецией кислоты. Как костеобразующие, так и костно-резорбтивные клетки используют кальциевые сигналы в качестве регуляторов дифференцировки и активности (Sims & Gooi 2008). Более подробно это изучено на остеокластах: и дифференцировка, и подвижность остеокластов регулируются кальцием.
Гомеостаз кальция в сыворотке крови достигается посредством сложного регуляторного процесса, при котором баланс между резорбцией кости, всасыванием и секрецией в кишечнике, а также реабсорбцией и выведением почками жестко регулируется остеотропными гормонами (Schepetkin 1997 ). Баланс концентраций ионизированного кальция в сыворотке крови является результатом сложного взаимодействия между паращитовидным гормоном, витамином D и кальцитонином. Другие остеотропные эндокринные гормоны, влияющие на метаболизм кости, включают гормоны щитовидной железы, половые гормоны и ретиноевую кислоту. Кроме того, фактор роста фибробластов способствует гомеостазу фосфатов. На рисунке показано, как поступление из пищи, из костной ткани, а также выведение через желудочно-кишечный тракт и мочу поддерживают гомеостаз.
Витамин D участвует в усвоении кальция, а паратгормон стимулирует высвобождение кальция из костей, снижает его выведение почками и способствует превращению витамина D в его биологически активную форму (1,25-дигидроксихолекальциферол) (Holick 2007). Снижение потребления кальция и витамина D, а также дефицит эстрогенов также могут способствовать развитию кальциевой недостаточности (Lips et al. 2006). Гормональные факторы, такие как ретиноиды, тиреоидные и стероидные гормоны, способны проходить через биологические мембраны и взаимодействовать с внутриклеточными рецепторами, оказывая существенное влияние на скорость резорбции костной ткани. Недостаток эстрогена увеличивает резорбцию костной ткани, а также снижает образование новой кости (Harkness & Bonny 2005). Апоптоз остеоцитов также был зафиксирован при дефиците эстрогенов. Помимо эстрогенов, важную роль в обмене костной ткани играет кальциевый обмен, а дефицит кальция и витамина D приводит к нарушению отложения костной ткани.
Циркулирующий паратгормон регулирует уровень кальция в сыворотке крови и высвобождается в условиях гипокальциемии. Он связывается с рецепторами остеобластов, увеличивая как экспрессию RANKL, так связывание RANKL с RANK на остеобластах (McCauley & Nohutcu 2002). Этот сигнал стимулирует ремоделирование костной ткани, активируя остеокласты, что в конечном итоге способствует высвобождению кальция из кости. Вторичная функция паратгормона заключается в увеличении реабсорбции кальция из почек. При терапевтическом введении в низких, периодических дозах этот гормон может действовать как анаболический агент, способствующий формированию костной ткани, хотя механизм этого действия недостаточно хорошо изучен.
Т-клетки вырабатывают кальцитонин, 32-аминокислотный пептид, основная физиологическая роль которого заключается в подавлении резорбции костной ткани. Рецепторы кальцитонина в большом количестве присутствуют на остеокластах и их предшественниках (Schepetkin 1997). Таким образом, кальцитонин способен воздействовать непосредственно на клетки остеокластов на всех стадиях их развития, чтобы уменьшить резорбцию кости путем предотвращения слияния мононуклеарных преостеокластов, ингибирования дифференцировки и предотвращения резорбции зрелыми остеокластами (McCauley & Nohutcu 2002). Концентрация и фосфорилирование рецепторов кальцитонина снижается в присутствии кальцитонина. В результате эффект кальцитонина на остеокласты является преходящим и поэтому не используется для клинической практики.
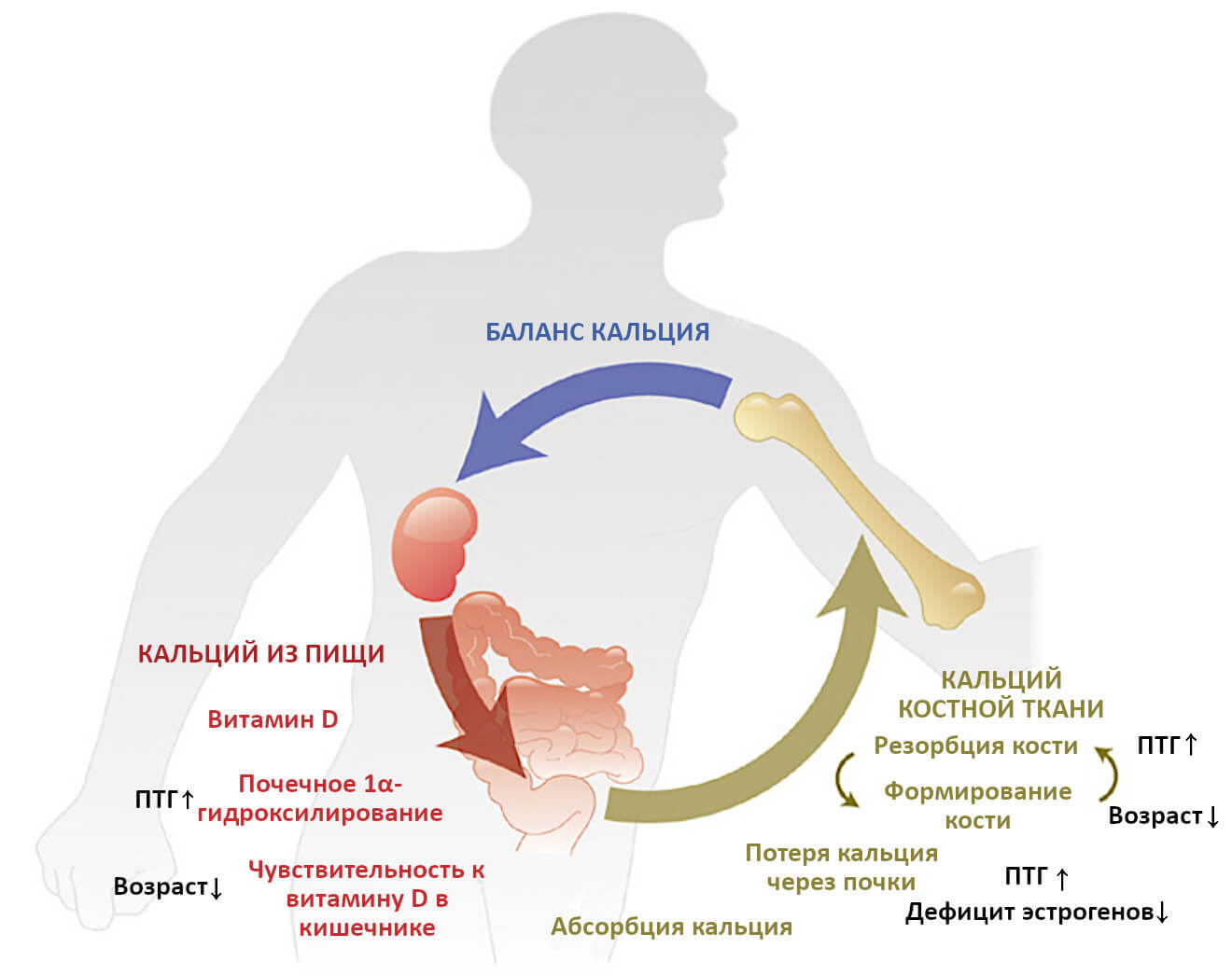
Рис.2. Кальций и костный метаболизм
Гомеостаз кальция имеет большое значение для многих физиологических процессов, поддерживающих здоровье. Баланс концентраций ионизированного кальция в сыворотке крови является результатом сложного взаимодействия между паратиреоидным гормоном (ПТГ), витамином D и кальцитонином. На рисунке показано, как поступление кальция из рациона и костей, а также его выведение через желудочно-кишечный тракт и мочу поддерживают гомеостаз. Витамин D участвует в усвоении кальция, а ПТГ стимулирует высвобождение кальция из костей, снижает его выведение почками и способствует превращению витамина D в его биологически активную форму (1,25-дигидроксихолекальциферол). Снижение потребления кальция и витамина D, а также дефицит эстрогена также могут способствовать развитию дефицита кальция
Скелетный гомеостаз
Заживление
В большинстве ситуаций, когда происходит повреждение тканей, заживление поврежденного участка приводит к образованию ткани, которая отличается по морфологии, составу или функциям от исходной ткани. Такой тип заживления называется репарацией. С другой стороны, регенерация тканей — это термин, используемый для описания процесса заживления, который приводит к полному восстановлению морфологии, состава и функции. Заживление костной ткани включает в себя как регенеративные, так и репаративные явления, в зависимости от характера повреждения.
Репарация
Травма костной ткани, будь то повторяющиеся нагрузки или единичный травматический эпизод, чаще всего приводит к перелому. При повреждении кости немедленно начинается сложный и многоступенчатый процесс заживления, чтобы облегчить восстановление. Пролиферация тканей и клеток опосредуется на разных стадиях различными факторами роста, воспалительными цитокинами и сигнальными молекулами. Несмотря на то, что процесс восстановления костной ткани является непрерывным, его можно условно разделить на три фазы — воспаление, репарация и ремоделирование (Hadjidakis & Androulakis 2006).
Фаза воспаления начинается сразу после повреждения ткани и длится около 2 недель (Fazzalari 2011). Первым шагом в процессе восстановления является образование кровяного сгустка. Выброс цитокинов из поврежденных клеток затем привлекает воспалительные клетки в область повреждения, где макрофаги начинают фагоцитоз поврежденных тканей и клеток. Остеокласты начинают процесс резорбции поврежденной кости в этой области, чтобы переработать минеральные компоненты. Кроме того, клетки миелоидной и мезенхимальной клеточных линий привлекаются в область, где они начинают дифференцироваться в остеобласты и хондробласты. В этот момент соотношение RANKL:остеопротегерин (OPG) снижается.
Репаративная фаза характеризуется образованием «мягкой мозоли», в которой начинает формироваться новый костный матрикс и хрящевой каркас. Остеобласты и хондробласты производят белковый каркас для создания этой мозоли, который медленно минерализуется, образуя «твердую мозоль». Твердая мозоль состоит из незрелой костной ткани. Инициация формирования хряща и периостальной кости в основном опосредуется ранней активацией интерлейкина 6 (IL‐6), OPG, фактора роста эндотелия сосудов (VEGF) и BMPs (Fazzalari 2011). Процесс формирования мягкой и твердой костной ткани происходит примерно через 6-12 недель с момента перелома кости.
На заключительном этапе восстановления, известном как фаза ремоделирования, костный матрикс и хрящ преобразуются в зрелую кость. Кость в конечном итоге превращается в зрелую пластинчатую кость в результате нормального костного обмена, опосредованного сочетанной функцией остеобластов и остеокластов. Достаточное количество витамина D и кальция имеет решающее значение для правильного восстановления костей, и их уровень может частично определять скорость восстановления. Стадия ремоделирования обычно занимает месяцы с момента травмы; однако оно варьируется в зависимости от индивидуальных особенностей метаболизма.
Регенерация
Оптимальное заживление кости способствует формированию тканей таким образом, чтобы сохранялась первоначальная структура и функция. Этот процесс отличается от восстановления тканей, при котором утраченная ткань просто заменяется искусственной и не восстанавливает полностью ни форму, ни функцию.
С течением времени кость повреждается в результате механических деформаций, перегрузок и других видов травм тканей, что приводит к образованию микропереломов и других дефектов. Чтобы предотвратить еще большее повреждение, кость подвергается естественному процессу ремоделирования, чтобы регенерировать или обновить себя. Скорость обновления в отдельных костях уникальна, хотя средняя скорость составляет 10 % (McCauley & Nohutcu 2002).
Регенерация костной ткани включает в себя взаимодействие процессов образования и резорбции костной ткани в базовой мультиклеточной единице (BMU) (Sims & Gooi 2008).
В этом процессе сначала происходит резорбция кости остеокластами в течение 3-4 недель, а также передача клеточных сигналов, способствующих привлечению остеобластов в эту область. Затем остеобласты формируют кость в течение 3-4 месяцев с периодом покоя между резорбцией и формированием кости, называемым фазой реверсии. Трабекулярная кость подвергается значительно большему обновлению костной ткани, чем кортикальная (McCauley & Nohutcu 2002). В модели заживления альвеолярной кости у грызунов этот процесс происходит быстрее, что позволяет оценить клеточные и молекулярные события, происходящие во время созревания новой регенерированной кости (Lin et al. 2011).
Регенерация костной ткани — нормальный процесс, однако в некоторых случаях возникает необходимость в ускоренной регенерации или в преодолении последствий патологических процессов. Терапевтические стратегии, способствующие регенерации костной ткани, включают использование костных трансплантатов из различных источников, барьерных мембран, антирезорбтивных средств, анаболических агентов и факторов роста, способствующих дифференцировке и пролиферации остеобластов (Giannobile et al. 2019).
При изменении костного обмена нарушается скелетный гомеостаз, что приводит к повышению или снижению минеральной плотности костной ткани (BMD) или некрозу костей и часто сопровождается снижением прочности. Гомеостаз костной ткани может нарушаться при самых разных заболеваниях, включая рак, менопаузу, прием лекарств, генетические заболевания, недостаток питательных веществ или инфекции. Некоторые из этих этиологических факторов, например дефицит витамина D, легко поддаются лечению, в то время как другие, такие как генетические мутации, обычно лечатся симптоматически. Изменения в костном гомеостазе вызывают широкий спектр симптомов, включая повышенную частоту переломов, боли в костях и другие деформации скелета, которые приводят к высокой степени заболеваемости, а в некоторых случаях и смертности.
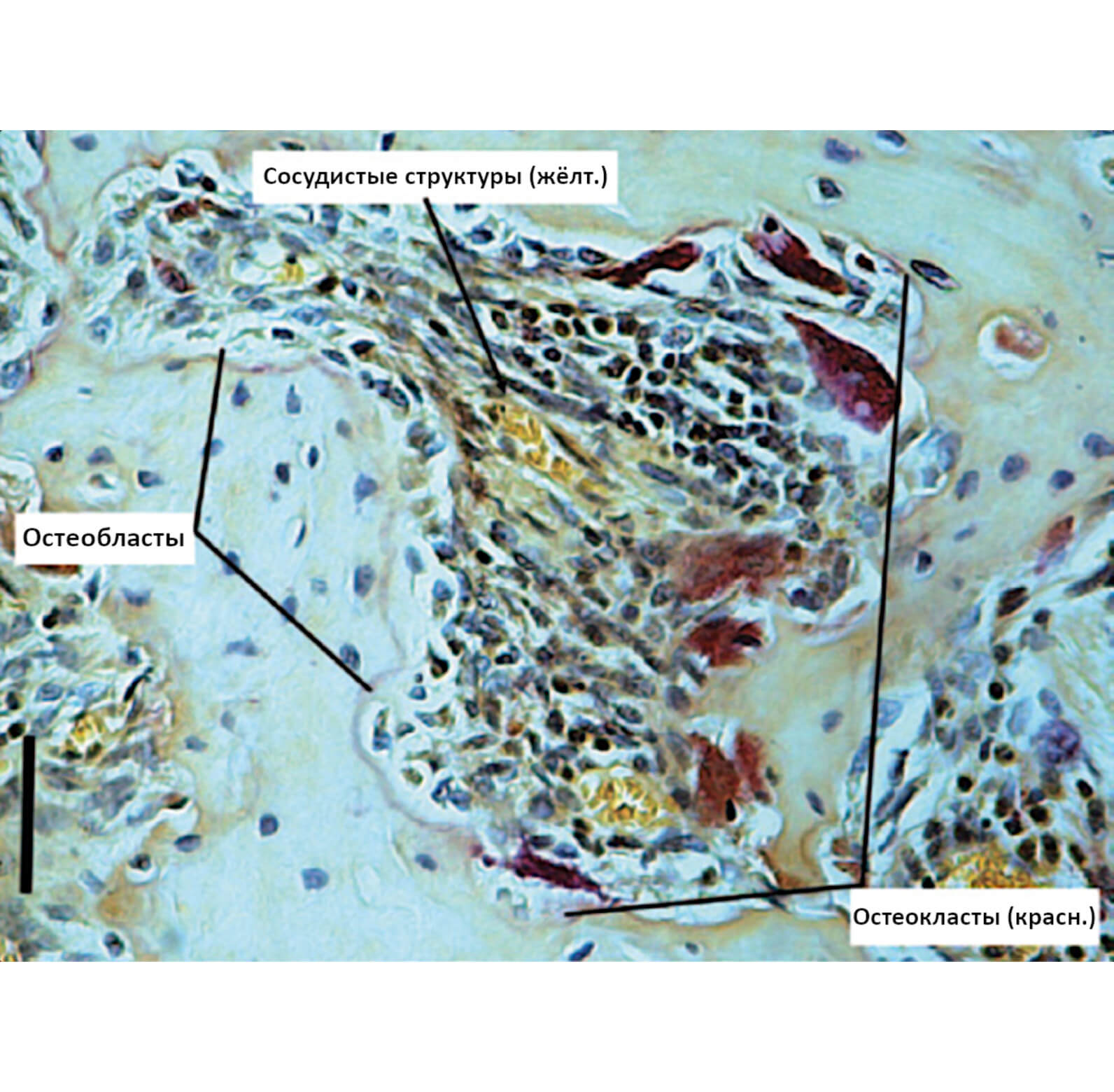
Рис.3. Костные мультиклеточные единицы (BMU)
Ремоделирование кости происходит в локальных группах остеобластов и остеокластов, называемых BMU; каждая единица организована в виде группы остеокластов, резорбирующих кость, за которым следуют остеобласты, реформирующие кость, чтобы заполнить дефект, оставленный остеокластами. Красное окрашивание (тартрат кислой фосфатазы) выделяет фронт резорбции. Обратите внимание на увеличенное количество многоядерных остеокластов в этой области
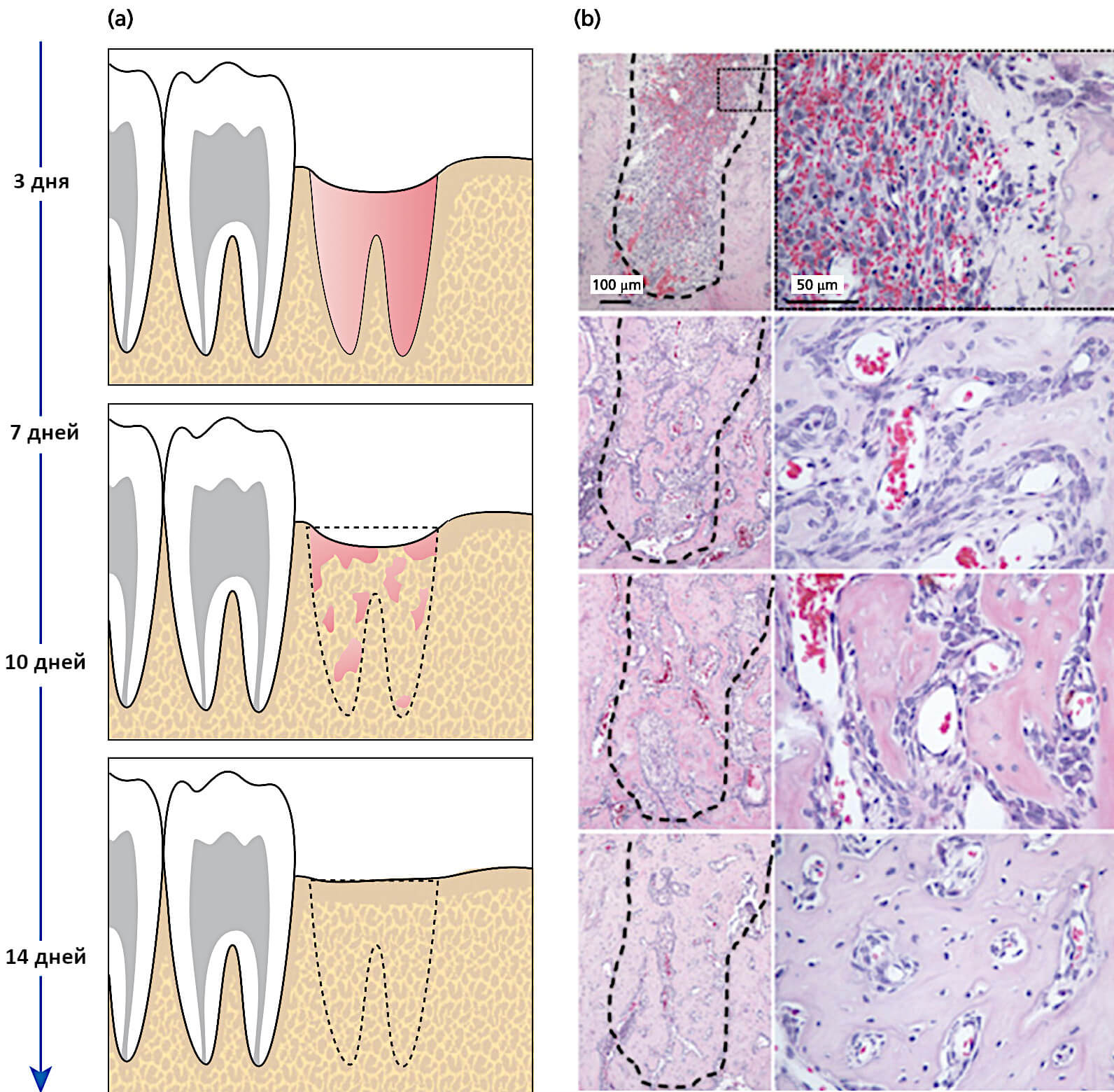
Рис.4. Заживления альвеолярной лунки с течением времени
(a) Модель — удаление зуба у грызуна. Последовательность событий, характеризующих заживление в течение первых 14 дней
(b) Окрашивание гематоксилином и эозином (H&E) участков заживления места удаления зуба. На гистологических изображениях справа от области заживления (черные пунктирные линии) отчетливо видна регенерация кости в пределах альвеолярного отростка. Обратите внимание на четко видимый кровяной сгусток на 3-й день. На 7-й день плотность клеток в области дефекта увеличивается. На 10-й день дефект заполняется уплотненной мезенхимальной тканью. Наконец, к 14-му дню отмечается интеграция новообразованной кости с первоначальными стенками лунки
Патологические процессы
Остеопороз
Остеопороз — распространенное заболевание, характеризующееся изменениями макро- и микроархитектуры кости. Существует множество этиологических факторов этого системного заболевания, включая постменопаузу, возрастные изменения, прием глюкокортикоидов, рак, отмена андрогенов и прием ингибиторов ароматазы (Kanis 2002). Все формы приводят к снижению прочности костей и повышению риска переломов, что сопровождается высокой заболеваемостью и смертностью.
Постменопаузальный остеопороз является наиболее распространенной формой заболевания и возникает в результате снижения секреции гонадальных гормонов после менопаузы. При этом заболевании характерна быстрая потеря трабекулярного и, в меньшей степени, кортикального коэффициента массы тела (Kanis 2002).
Диагноз ставится путем сравнения BMD пациента и здорового 20-29-летнего взрослого человека того же пола. Системный показатель BMD, по крайней мере, на 2,5 стандартных отклонения ниже среднего, называемый T-score, используется Всемирной организацией здравоохранения (ВОЗ) для определения остеопороза (ВОЗ 1994; McCauley 2020). Остеопения, менее тяжелая форма заболевания, диагностируется, если показатели T-score составляют от -1,0 до -2,5.
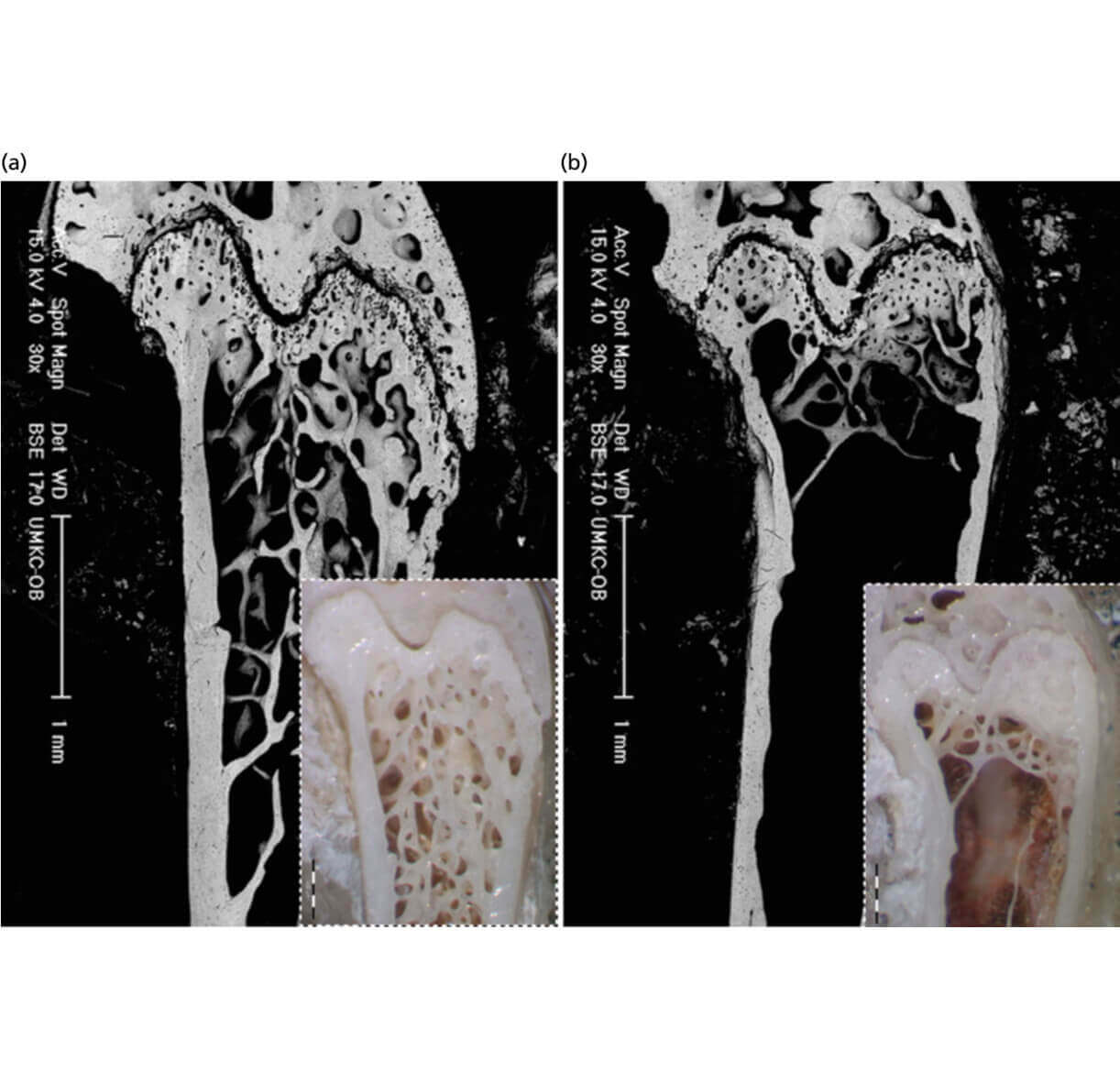
Рис.5. Остеопороз
При остеопорозе уменьшается толщина кортикального слоя, а также заметно снижается количество трабекул и их связность. С течением времени этот процесс продолжается, происходит дальнейшее ухудшение внутренней архитектуры, что значительно влияет на способность кости выдерживать нагрузки без разрушения
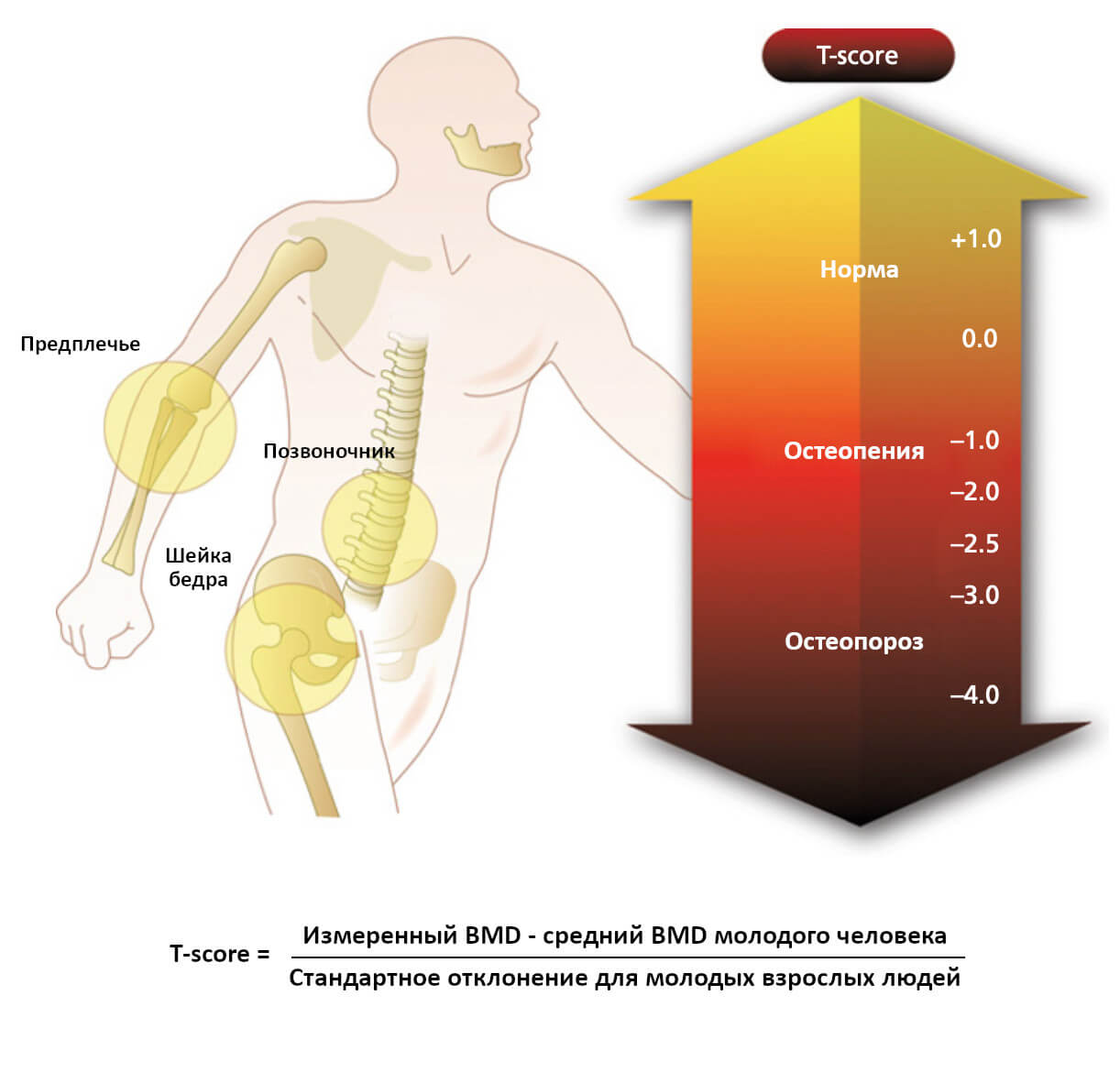
Рис.6. Минеральная плотность костей (BMD)
Двухэнергетическая рентгеновская абсорбциометрия или рентгеновская денситометрия (DEXA) считается предпочтительным методом измерения BMD. Чаще всего для измерения BMD с помощью DEXA используются позвоночник, шейка бедра и предплечье. Всемирная организация здравоохранения определяет остеопороз на основе показателя «Т-score». Он означает количество стандартных отклонений выше или ниже среднего значения для здорового 30-летнего взрослого человека того же пола, что и пациент
Остеопетроз
Остеопетроз — это группа родственных заболеваний, при которых наблюдается выраженное увеличение BMD за счет аномального обмена костной ткани, и в некотором смысле это противоположность остеопорозу. Эти заболевания наследуются, а способ передачи варьируется от аутосомно-доминантного до аутосомно-рецессивного. Увеличение BMD в этой популяции пациентов обусловлено различными дефектами остеокластической резорбции кости. К ним относятся повышенное или пониженное количество остеокластов, нарушение дифференциации, дефицит карбоновой ангидразы, способности формировать гофрированную каемку и изменения в сигнальных путях (Stark & Savarirayan 2009). В большинстве случаев способность остеокластов создавать кислую среду в лакунах для резорбции кости в той или иной степени нарушается, что в конечном итоге приводит к увеличению образования кости.
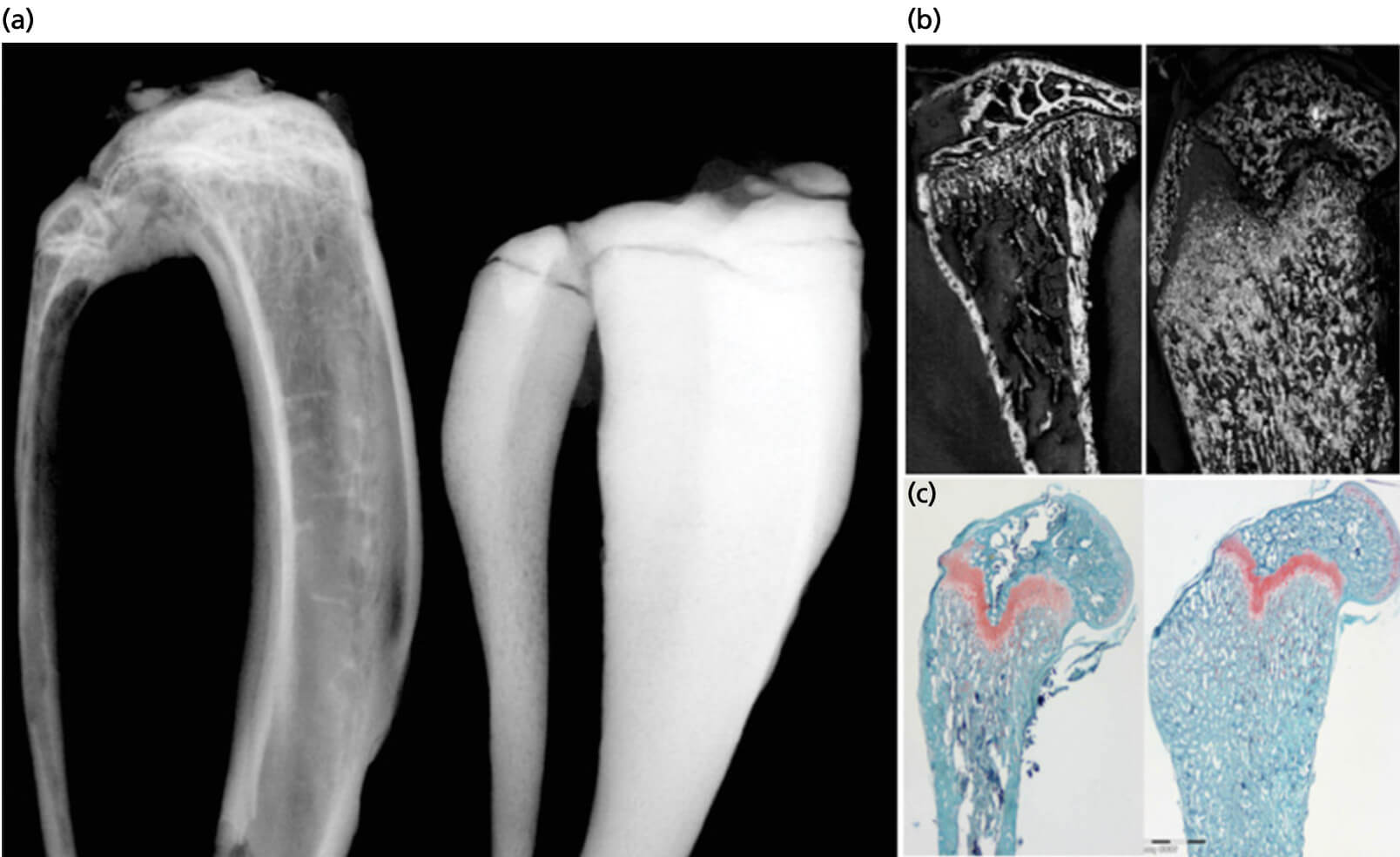
Рис.7. Остеопетроз
Повышенная плотность и отложения минерализованного костного матрикса — обычная находка для больных остеопетрозом
(a) облитерация костномозговой полости
(b) картина при сканирующей электронной микроскопии
(c) картина при окрашивание сафранином-О
Остеомаляция
Витамин D необходим для метаболизма калия и фосфора в организме, которые являются ключевыми минералами, необходимыми для формирования костей (Holick 2007).
Дефицит витамина D, или неспособность усваивать этот витамин, является распространенным состоянием, особенно в северном климате, поскольку витамин D поступает в организм главным образом через солнечный свет и пищу. К дефициту витамина D могут привести и другие заболевания, например, онкогенные или доброкачественные опухоли и болезни печени.
При недостатке витамина D нарушается минерализация костей, что приводит к заболеванию, называемому остеомаляцией. Когда заболевание возникает у детей, его называют рахитом. Основными признаками остеомаляции являются кости, которые содержат нормальный коллагеновый матрикс и остеоидную структуру, но не имеют должной минерализации, что приводит к их размягчению (Russell 2010). Остеомаляция отличается от остеопороза тем, что остеомаляция изменяет кость в процессе ее развития и формирования, в то время как остеопороз ослабляет уже сформировавшиеся костные структуры.
Тяжесть заболевания варьируется в широких пределах — от бессимптомного проявления до смерти в раннем детстве. Несмотря на увеличение плотности костной ткани, вновь сформированная кость имеет низкое качество, и симптомы включают повышенную частоту переломов, невропатию и низкий рост. Лечение остеомаляции заключается в устранении дефицита витамина D, как правило, с помощью диетических добавок в сочетании с устранением причины дефицита. В тяжелых случаях на ранних стадиях лечение этого состояния может включать пересадку костного мозга. Дефицит витамина D также может быть связан с плохими результатами регенерации после хирургии пародонта (Bashutski et al. 2011).
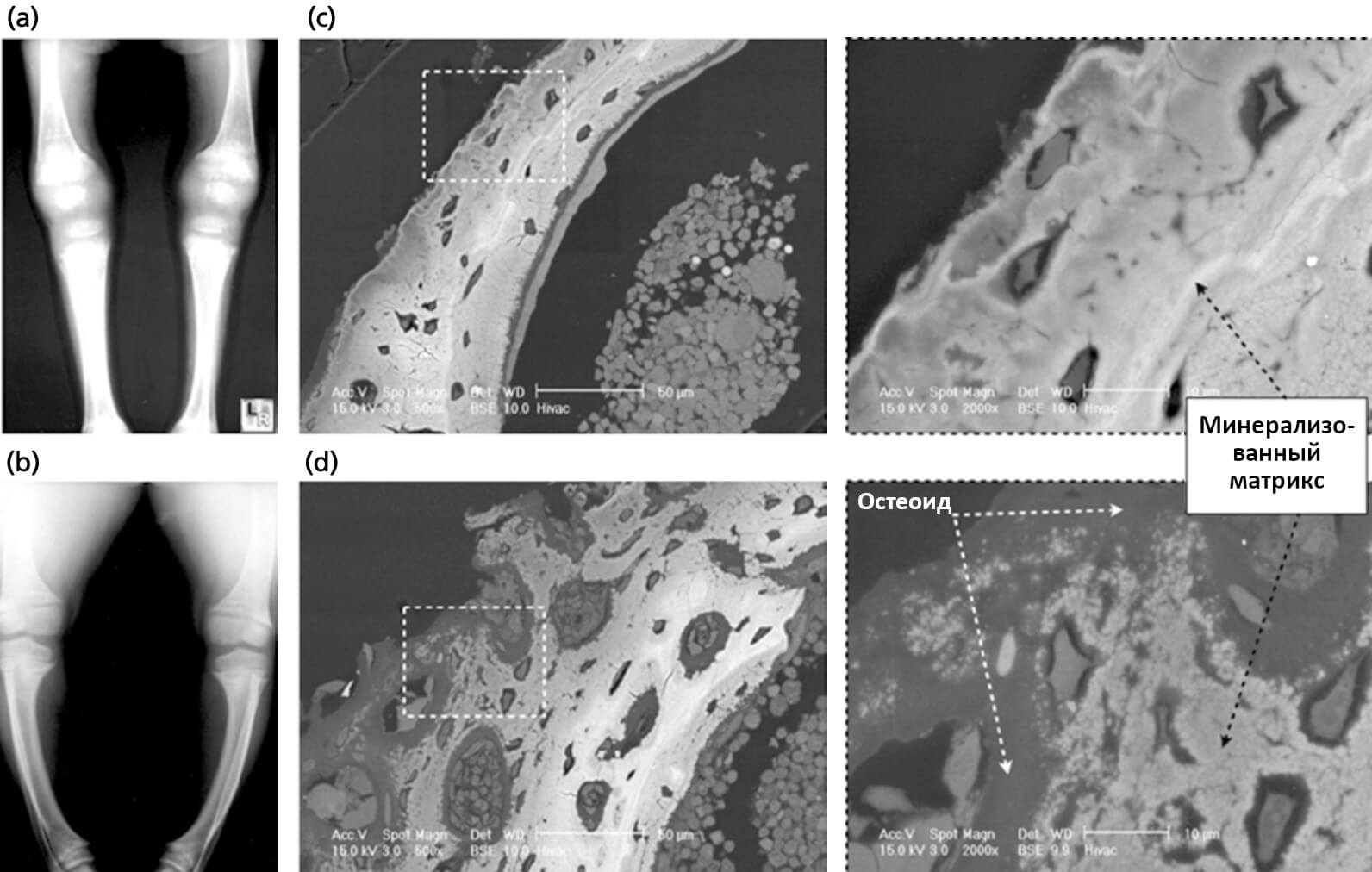
Рис.8. Остеомаляция
(a, c) Нормальная минерализация и созревание матрикса
(b, d) При остеомаляции присутствуют большие гипоминерализованные зоны, сопровождающиеся увеличением отложений остеоида/незрелого матрикса
Остеонекроз
При длительной ишемии костной ткани, часто из-за прекращения кровоснабжения, происходит гибель клеток. Клетки кроветворной линии наиболее подвержены негативному воздействию ишемии и не могут прожить более 12 часов без адекватного кровоснабжения (Steinberg 1991). Клетки, непосредственно отвечающие за минерализацию и обмен костной ткани, — остеобласты, остеокласты и остеоциты — менее чувствительны к аноксии, хотя гибель клеток наступает и в них после 48 часов аноксии. Если приток крови возобновляется быстро, то может произойти заживление и восстановление. Однако по истечении этого критического периода времени наступают необратимые процессы, что потребует частичной или полной резекции с последующей реконструкцией.
Остеонекроз имеет множество этиологий, включая радиационное воздействие, применение бисфосфонатов, стероидов, гипертонию, а в некоторых случаях артрит или волчанку. Связанный с бисфосфонатами остеонекроз челюсти (ONJ) вызывает все большую озабоченность в стоматологической сфере. ONJ определяется как участок обнаженной кости, который не заживает в течение 8 недель после выявления медицинским специалистом (Khosla et al. 2008). Пациенты с диагнозом ONJ, связанным с бисфосфонатами, включают только тех, кто не подвергался предварительному облучению черепно-лицевой области. Пероральный прием бисфосфонатов связан с меньшим риском и составляет 0,01-0,04%; в отличие от пациентов, принимающих внутривенные бисфосфонаты, у которых частота возникновения существенно выше — 0,8-12% (Vescovi & Nammour 2011). Такая высокая частота, вероятно, объясняется более высокими дозировками при внутривенном введении, а также тяжестью и степенью заболевания, которое лечится. Пероральные бисфосфонаты обычно используются для лечения остеопороза, в то время как внутривенные бисфосфонаты назначаются для лечения болезни Педжета, множественной миеломы и других заболеваний.
Остеомиелит
Остеомиелит — это инфекционный процесс в костной ткани, которая может быть классифицирована в зависимости от источника инфекции, прогноза, анатомии кости, факторов организма хозяина и клинической картины (Calhoun & Manring 2005). Открытые переломы, хирургические вмешательства, а также такие заболевания, как сахарный диабет и болезни периферических сосудов, повышают риск развития остеомиелита. Остеомиелит из гематогенного источника гораздо чаще встречается в педиатрической практике.
Окончательный диагноз остеомиелита ставится путем выделения бактерий в сочетании с диагностической картиной, но это может быть непросто. Лечение включает в себя антибиотикотерапию в сочетании с дренированием, хирургической обработкой и другими соответствующими хирургическими методами, включая стабилизацию кости и пересадку кожи (Conterno & da Silva Filho 2009).
Несовершенный остеогенез
Несовершенный остеогенез — это группа генетических заболеваний, при которых нарушается образование коллагена, что приводит к снижению качества кости. Переломы, хрупкость костей и остеопения являются общими признаками этого заболевания. Патология встречается относительно редко, с частотой 1 на 10 000 новорожденных.
Существуют аутосомно-доминантные и рецессивные формы, хотя аутосомно-доминантная форма встречается чаще (Michou & Brown 2011).
Клиническая картина имеет общие черты с другими заболеваниями костного метаболизма, включая переломы, деформации костей и патологии суставов. Кроме того, к отличительным особенностям Унесовершенного остеогенеза относятся потеря слуха, хрупкость сосудов, голубые склеры и несовершенный дентиногенез. Дефекты коллагена I типа, включая нарушения взаимодействия между коллагеном и неколлагеновыми белками, ослабление матрикса, дефекты взаимоотношений между клетками и матриксом, а также дефекты минерализации тканей связаны, как правило, с аутосомно-доминантными формами (Forlino et al. 2011). При рецессивной форме дефицит любого из трех компонентов комплекса пролил-3-гидроксилирования коллагена приводит к снижению способности проколлагена I типа подвергаться посттрансляционной модификации или скручиванию. Тяжесть заболевания, а также наличие определяющих признаков широко варьируются.
Для лечения симптомов несовершенного остеогенеза используются различные методы терапии, включая хирургическое вмешательство, сотрудничество с разными специалистами, например, ЛОР, стоматологии и другие, а также медикаментозное лечение, например назначение бисфосфонатов и рекомбинантного гормона роста.
Другие заболевания
Некоторые другие заболевания могут влиять на гомеостаз костной ткани, включая первичный и вторичный гиперпаратиреоз, болезнь Педжета и фиброзную дисплазию.
Гиперпаратиреоз — это избыточная выработка ПТГ(паратгорон), который способствует резорбции кальция и фосфора из костей для повышения уровня кальция в сыворотке крови до нормальных значений (Unnanuntana et al. 2011). Первичный гиперпаратиреоз чаще всего вызван аденомой паращитовидной железы, а вторичный гиперпаратиреоз возникает при избыточной выработке ПТГ в ответ на низкий уровень кальция в сыворотке крови. Гиперпаратиреоз часто протекает без симптомов и обнаруживается при плановом обследовании. Клиническая картина очень похожа на рахит. Лечение включает в себя выявление и устранение причины, вызвавшей заболевание.
Болезнь Пэджета — это состояние, при котором уровень метаболизма костной ткани значительно превышает норму, а образование костной ткани превышает ее рассасывание (Noor & Shoback 2000). Это приводит к чрезмерному образованию костной ткани и может затрагивать одну или несколько костей. Чаще всего страдают кости таза. Пораженные кости, несмотря на повышенное образование костной ткани, слабы и деформированы. Это связано с неравномерным формированием коллагеновых волокон в костях. Терапия бисфосфонатами эффективна для уменьшения скорости образования костной ткани в этой популяции пациентов, однако это сопряжено с повышенным риском развития ONJ. Примерно у 0,01-0,04 % пациентов, принимающих бисфосфонаты для лечения болезни Педжета, развивается ONJ (Vescovi & Nammour 2011).
Фиброзная дисплазия может поражать несколько костей, но в 60 % случаев поражается только одна кость (Michou & Brown 2011). Чаще всего патология проявляется в детском возрасте. Очаги фиброзной дисплазии формируются в костномозговой полости, распространяясь на кортикальную кость, и состоят из гиалинового хряща, незрелой кости и клеток-предшественников остеобластов. Симптомы этого заболевания включают переломы и боль в костях. Примечательно, что у этого заболевания есть и другие черепно-лицевые симптомы, включая деформации черепно-лицевых костей, экзофтальм и аномалии зубов.
Заключение
Как видно из вышеизложенных данных, динамическая природа костной ткани и связанных с ними структур является важной системой организма, которая поддерживает форму и функцию скелета, включая челюстные кости. В этом материале был представлен обзор сложных и скоординированных процессов развития костной ткани и гомеостаза во время здоровья и болезни.
Перевод материала «Bone as a Living Organ» Hector F. Rios, Jill D. Bashutski, William V. Giannobile выполнен специально для проекта «Современная пародонтология»
