С конца 19 века было сформировано представление, что при лечении пародонтита основной метод лечения – это хирургический подход. Базовая парадигма этиологии патогенеза заболеваний пародонта была основана на распространении процесса в альвеолярной кости и, следовательно, инфицированные ткани должны были быть удалены хирургическим путем для достижения заживления. Следовательно, сначала «радикальная» гингивэктомия, а затем лоскутные операции в хирургии пародонта были полностью обоснованы.
Пародонтологическое лечение: история вопроса
Лоскутные операции в хирургии пародонта берут свое начало приблизительно в 1910 году и их первое применение связано со следующими именами: Neuman (Берлин) , Cieszynski (Львов) и Widman (Стокгольм). Однако довольно трудно проследить первоначальное обоснование и методы, применяемые разными авторами и, следовательно, не один из перечисленных клиницистов не может быть назван «изобретателем» пародонтального лоскута.
Между вторым и девятым десятилетиями 20-го века, пародонтальные хирургические вмешательства находили свое применение в зависимости от обоснования патогенеза . После первой эры лоскутной хирургии, пропагандируемой Neuman и Widman (операция была направлена на альвеолярную кость, которая, как полагали, инфицирована), было продемонстрировано, что костные поражения не были инфицированы, а скорее имели признаки резорбции. С этого времени второе рождение получили операции гингивэктомии, они то частично заменили лоскутную хирургию.
Впоследствии, в 1949 году, Schluger опубликовал свой взгляд на хирургию пародонта, в том числе определил принципы костной резекции как основы для формирования профиля мягких тканей. Как следствие, лоскутная хирургия была возвращена заново на долгие годы.
В 1974 году Ramfjord описал свою новую технику модифицированного лоскута по Widman. Вместо уменьшения кармана через костную резекция, он предложил принципиально другое обоснование лечения. Было предложено, сконцентрировать основное внимание на закрытие или уменьшение кармана по средством тщательной обработки корневых поверхностей. Поверхность корня должна была быть “биологически приемлемым” для того, чтобы запустить процесс заживления, в результате которого происходи закрытие пародонтального кармана с или без формирования длинного соединительного эпителия.
Ни один из различных хирургических методов не был проверен в течение длительного времени и, как результат мнение клиницистов по использованию той или иной методики отличалось в различных частях мира.
Все резко изменилось после начала исследования пародонтальной терапии, впервые инициированной Мичиганской группой, и впоследствии поддержанной Гетеборгской группой и группой из Небраски. Эти исследования в основном сравнивали клинические результаты различных хирургических методик, таких как гингивоэктомия, удаление кармана путем резекции кости, проведение репаративных операций для закрытия кармана и поддесневой кюретаж.
В то время, не проводилось никаких сравнений с результатами нехирургических подходов в лечении.
Появление нехирургической концепции лечения
До середины 1980‐х годов пародонтологическое лечение всегда включало пародонтальную хирургию по той или иной методике. Изолированно консервативное лечение никогда не применялось, и даже считалось халатностью не применять хирургические методы лечения для пародонтологического пациента. Нехирургическая часть считалась подготовительной и, следовательно, неполной.
Наконец, в 1981 и 1983 годах Миннесотская группа опубликовала рандомизированное контролируемое клиническое испытание, в котором пародонтологическое лечение с применением скейлинга и сглаживания корней зубов в сочетании с лоскутной операцией сравнивалось с изолированным применением скейлинга.
17 пациентов с пародонтитом средней и тяжелой степени тяжести получили качественное лечение с применением скейлинга сглаживания корней в сочетании с инструкциями по гигиене полости рта. Модифицированная лоскутная операция по Widman затем случайным образом выполнялась для половины пациентов.
Повторный осмотр, включая комплекс гигиены и повторный инструктаж по гигиене, были проведены через 6,5 лет после завершения лечения.
Это была первая точка прямого сравнения хирургического и терапевтического подходов с нехирургическим методом лечения. В долгосрочной перспективе результаты (относительно уменьшения кармана и поддержания уровня прикрепления) значительно не отличались для повреждений с начальным глубина зондирования до 6 мм, таким образом, нехирургический подход стал общепринятым вариантом лечения без клейма халатности.
Только в участках пародонта с начальной глубиной зондирования ≥7 мм отмечалось значительное уменьшение глубины кармана в группе, где в дополнении к скейлингу использовалась лоскутная операция. Однако, уровень прикрепления был сохранен в обоих группах , даже в тех участках, где имелись глубокие поражения.
Действительно, миннесотское исследования инициировало сдвиг парадигмы пародонтологического лечения в сторону нехирургического подхода.
Этот тренд был дополнительно обоснован исследованиями, которые начали оценивать исход нехирургического подготовительного этапа пародонтологического лечения перед оперативными вмешательствами. Средние значения измерений для карман глубиной 1-3мм, 4-6мм, и ≥ 7 мм до лечения сравнивались с результатами после лечения. Глубина зондирования значительно уменьшилась для карманов ≥4 мм. Удивительно, но большая часть уменьшений глубины зондирования и увеличение уровня клинического прикрепления можно отнести к нехирургическому этапу лечения (гигиеническая фаза), а не к оперативному этапу, проводимому после.
В категории, где глубина зондирования 4-6 мм, средняя разница в глубине кармана до и после
была 0,96 ± 0.47 мм (P < .0001), в то время как для карманов ≥7 мм, средняя разница составила 2,22 ± 1,35 мм (р < .0001). Увеличение уровня прикрепления составили около 50% от изменения глубины зондирования.
Данное исследование наглядно демонстрирует, что клиническая тяжесть пародонтита
была значительно уменьшена через 1 месяц после гигиенического этапа и, следовательно, необходимость хирургического вмешательства может быть оценена должным образом только после завершения нехирургического этапа лечения пародонта. Как следствие, нехирургический этап лечения должен рассматриваться как предпосылка и основа для любого вида пародонтологического лечения.
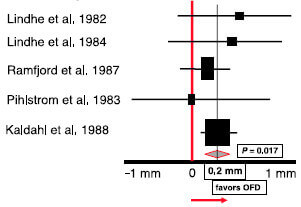
Мета-анализ, проведенный по систематическим обзорам, отражает эффективность нехирургической пародонтальной терапии, самостоятельно или в сочетании с хирургическим вмешательством. Превосходство дополнительно проводимого хирургического вмешательства определялось по увеличению уровня прикрепления (средневзвешенное значение = 0,2 мм).По результатам значения начальной глубины зондирования были
> 6 мм. Были получены данные, основанный на наблюдении за пациентами в течение 12 месяцев. CAL-уровень клинического прикрепления, OFD- «открытое» снятие отложений,PPD- глубина пародонтального зондирования.
Нехирургическая пародонтология и хирургическая концепция
Продольные исследования, проведенные в течение 1980-х годов несколькими группами клиницистов, включали нехирургические методы лечения в качестве группы контроля в сравнении с различными хирургические методики. Таким образом, была создана база данных, которая позволила сравнивать результаты только нехирургических методик с результатами комплексного лечения, когда хирургии предшествовала консервативная терапия.
На European Workshop on Periodontology в 2002 году терапевтические концепции обсуждались на основе систематических обзоров. Для консервативной терапии был поставлен следующий вопрос, ответ на который был получен на основании рандомизированных контролируемых клинических испытаниях с периодом наблюдения не менее 12 месяцев: “есть ли разница между открытым снятием отложений с формированием лоскута (OFD, хирургическая обработка) и скейлинга в сочетании со сглаживанием корней (SRP, нехирургическая обработка) с точки зрения результатов лечения ?».
Как наиболее релевантный параметр оценки результатов терапии была выбрана потеря зуба, при этом требовался весьма длинный период наблюдения, дополнительные критерии также были выбраны для оценки лечения. Они включали разрешение гингивита (кровоточивость при зондировании), уменьшение глубины зондирования и клинические изменения уровня прикрепления.
Было использовано 589 обзоров, которые могли бы быть использованы для ответа на поставленный вопрос и при этом соответствовали критериям включения, среди рандомизированных испытаний только 6 прошли соответствующий отбор. Учитывались только изменения, связанные с пациентом, через 12 месяцев после терапии. Всего было проанализировано 235 пациентов.
Метаанализ этих исследований показал, что в неглубоких карманах глубиной 1-3 мм, через 12 месяцев после обработки, нехирургические методики привели к уменьшению потери прикрепления на 0,5 мм меньше (средневзвешенная разница= -0.51 мм; 95% ДИ: -0.74 до-0.29), чем при хирургическом лечении.
В карманах с глубиной зондирования 4-6 мм SRP привело к увеличению значения прикрепления на 0,4 мм (средневзвешенное значение разницы = -0.37 мм; 95% ДИ: -0.49 до -0.26) и на 0,4 мм уменьшение глубины зондирования (средневзвешенная разность = 0,35 мм; 95% ДИ: 0.23‐0.47), чем хирургическое лечение.
Однако, в глубоких карманах >6 мм, на 0,6 мм больше отмечалось уменьшение глубины зондирования (средневзвешенная разность = 0.58 мм; 95% ДИ: 0.38-0.79), и на 0,2 мм больше увеличение клинического прикрепления (средневзвешенная разница = 0,19 мм; 95% ДИ: 0,04-0,35)в группе применения хирургии после начальной консервативной терапии по сравнению только с консервативной терапией.
В категории глубоких пародонтальных карманов (≥7 мм), формирование лоскута оказывает значительно большее влияние на стимулирование прироста клинического прикрепления, чем при изолированном применении SRP.
Очевидно, что пародонтальная хирургия может только способствовать достичь лучших результатов при лечении глубоких поражений, в то время как при поражениях до 6 мм, консервативное воздействие может быть одинаково эффективным в снижении глубины зондирования и формировании уровня прикрепления. Следовательно, можно сказать , что нехирургическая терапия намного эффективнее, чем до сих пор считалось. С другой стороны, очевидно, что нехирургические пародонтальная терапия должна предшествовать хирургическому лечению.
Понятие «критическая глубина зондирования»
Для долгосрочного поддержания результатов лечения оценка уровня клинический прикрепления на протяжении многих лет может быть самым важным дополнительным оценочным параметром. Так как в исследованиях не было зафиксировано серьезных различий в параметре уровне клинического прикрепления между группами с хирургическим лечением и без него, для клинициста важно понимать , в каких случаях можно ограничится только нехирургическим лечением, а в каких необходимо прибегать к хирургии для получения наилучших терапевтических результатов. В этом процессе принятия решений понятие » критическая глубина зондирования » может быть полезна для предтерапевтической оценки каждого конкретного случая. Однако следует понимать, что в этом регрессионном анализе использовались данные, сгенерированные как средние значения из исследований, сравнивающих консервативное лечение и дополнительные хирургические вмешательства для сглаживания корней зубов. Следовательно, данная концепция может быть ценным инструментом принятия решений для определения направления исходов лечения. “Критическая глубина зондирования” по отношению к клиническому изменению уровня прикрепления, была рассчитана для различных подходов, включая нехирургические и дополнительные хирургические методы. Изменение уровня клинического прикрепления строится на графике относительно начальной (предтерапевтической) глубины зондирования. Впоследствии, линия так называемой регрессии может быть легко рассчитана. Точка, в которой линия регрессии пересекает горизонтальную ось (начальная глубина зондирования) определяется как критическая глубина зондирования. Это, в свою очередь, означает, что критическая глубина зондирования указывает на измерения глубины кармана до соответствующего лечения, ниже которой клиническое прикрепление будет потеряно, как результат соответствующей процедуры лечения. С другой стороны, выше критической глубины зондирования, лечебные процедуры будут приводить к увеличению уровня прикрепления.
В качестве примера на Графике представлен регрессионный анализ для нехирургического и хирургического лечения по результатам рандомизированного контролируемого клинического исследования. Критическая глубина зондирования при оценке имеет большее значение для дополнительного хирургического подход а, чем для консервативного лечения. Линия регрессии для нехирургической терапии (только SRP) пересекает горизонтальную ось при критической глубине зондирования 2,9 мм. Это, в свою очередь, означает, что нехирургическое лечение приводит к потере прикрепления при клинической глубине зондирования составляет, в среднем, 2,9 мм. Выше этого значения, консервативное лечение по всей видимости приведет к увеличению уровню прикрепления . Для дополнительного хирургического подхода (модифицированный лоскут по Widman) критическая глубина зондирования составляет 4,2 мм, что свидетельствует о том, что при хирургическом вмешательстве результаты по увеличению клинического прикрепления будут достигнуты при глубине зондирования не менее 4.2 мм.
Сравнение обеих линий регрессии (т. е. для нехирургических методов лечения и в дополнении с хирургией) показывает, что линии пересекаются на критической глубине зондирования 5,4 мм. Опять же, это означает, что только при работе с очагами деструкции глубиной около 5.5 мм можно использовать как дополнение хирургическое вмешательство, при этом участки с меньшей глубиной зондирования явно требуют только нехирургической терапии.
В заключение можно констатировать, что заболевания пародонта можно успешно лечить с помощью нехирургических методов лечения и дополнительные хирургические вмешательства следует рассматривать только при критической глубине зондирования 6 мм. Это ограничивает пародонтологические хирургические вмешательства только теми случаями, когда глубина зондирования сохраняется больше 6 мм после успешно проведенного гигиенического этапа.
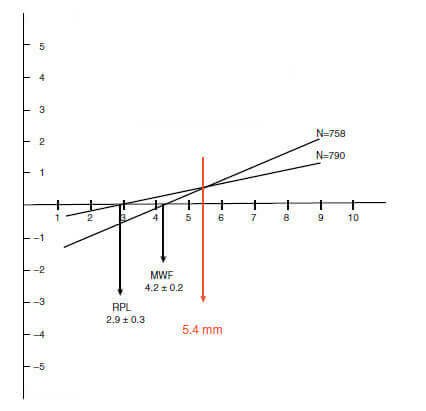
Критическая глубина зондирования. Регрессионный анализ после нехирургического лечение (удаление зубных отложений+полировка RPL) и после дополнительного хирургического лечения (модифицированная лоскутная операция по Widman MWF). По графику видно, что критическая глубина зондирования для RPL составляет 2,9 мм, а для MWF -4,2 мм. Однако, преимущество дополнительной хирургии становится очевидно только при глубине зондирования >5.4 мм
Средине значения или отдельные сегменты
Очевидно, что клиницисты при предтерапевтической оценке фиксируют параметры только для отдельных участков полости рта (сегменты), в то время как упомянутые подходы были разработаны по средним значениям по данным исследований. Кроме того, очевидно, что терапевтические исходы терапии могут или не могут быть поддержаны на одном уровне с течением времени. Это зависит от уровня сотрудничество врача и пациента, уровня гигиены полости рта, а также проводимой поддерживающей терапии.
Длительные групповые исследования (14 лет) показали что, в то время как подавляющее большинство пародонтальных сегментов остаются стабильными на протяжении многих лет, очень небольшая доля (<1%) примерно у 25% (15 из 61) из пролеченных х пациентов имеют признаки реинфекции и дальнейшую потеря прикрепления, несмотря на получение адекватной поддерживающей терапии. Это повторное инфицирование произошло независимо от продолжительности активной фазы лечения или критической глубины зондирования. Это указывает на то, что реинфекция хорошо пролеченных и поддерживаемых сегментов тканей пародонта встречаются редко и полностью непредсказуема. Только треть из этих реинфицированных участков (n = 15) была связана с глубокими карманами; остальные две трети были отмечены в мелких карманах (n = 28). Следовательно, нельзя точно утверждать, что нехирургическая или дополнительная хирургическая фаза лечения может обеспечить лучшие долгосрочные результаты.
Недавнее исследование, посвященное долгосрочной поддерживающей терапии (11 лет) пациентов с пролеченным пародонтитом , подтвердило этот вывод. В то время как у большинства пациентов была получена стабилизация процесса, около 40% из пациентов имели одиночные очаги с реинфекцией. В том исследовании, обработанные участки с остаточной глубиной зондирования ≥6 мм имели значительно более высокий риск потери зуба, чем если бы глубина зондирования была
Нехирургическое лечение периимплантных состояний. Мукозит
Периимплантные состояния объединяют (i) воспалительные поражения вокруг имплантатов без потери опорной кости (т. е. мукозит) и (ii) мукозит с дополнительной потерей опорной кости (т. е. периимплантит). Клинические признаки воспаления слизистой оболочки могут включать кровоточивость при зондировании, покраснение, отек и нагноение. Начало заболевания характеризуются наличием этиологических факторов аналогично тем, которые участвуют в этиологии заболеваний пародонта.
Причинно-следственная связь между экспериментальным накоплением биопленки вокруг дентальных имплантатов и развитие экспериментального мукозита было показано в исследованиях с участием людей. Следовательно, механическое удаление и последующий контроль биопленки вокруг имплантов рассматриваться в качестве стандарта лечения и профилактики мукозита как у пациентов.
Мукозит считается предшественником периимплантита. Сообщалось, что периимплантный мукозит распространен среди пациентов, не придерживающихся регулярной поддерживающей терапии. Распространенность таких состояний была 48% во время наблюдения в течение 9-14 лет.
В продольном исследовании пациентов, которым поставлен диагноз мукозит, в случае отсутствия поддерживающей терапии в 43,9% случаев в течение 5 лет развился периимплантит против 18% пациентов, придерживающихся регулярной поддерживающей терапии.
Анализ логистической регрессии показал, что отсутствие приверженности к поддерживающей терапии в целом среди пациентов в значительной степени был связан с наступлением периимплантита (отношение шансов = 5.92). Кроме того, результаты проспективного клинического исследования показали, что имплантаты, установленные у пациентов, которые проходили лечение по поводу пародонтита и при этом проходили поддерживающую терапию, показали развитие мукозита в 20% случаев в течение 5 лет наблюдения. При этом все имплантаты, кроме одного, были успешно сохранены в результате проведенного лечения.
Результаты 3‐месячного рандомизированного плацебо‐контролируемого клинического исследования показали, что механическая обработка участка раны в сочетании с оптимальной индивидуальной гигиеной с назначение геля хлоргексидина или без него, дали полное разрешение процесса и отсутствие кровоточивости при зондировании около 38% имплантатов с диагнозом мукозит.
Кроме того, имплантаты с надслизистым расположением края реставрации показали большее сокращение глубины зондирования после лечения мукозита, чем те, у которых имелось подслизистой расположение края реставрации.
Результаты рандомизированного плацебо-контролируемого клинического исследования не дали результатов, показывающих существенное различия между группами лечения, где механическая обработка сочеталась или нет с системным применением азитромицина.
6-месячные клинические улучшения наблюдались в группе азитромицина, были отнесены к улучшению уровня гигиены и противовоспалительным свойствам системного антибиотика. Тем не менее, результаты этого исследования не доказывают необходимость системного антибиотика при лечении мукозита.
Следовательно, основываясь на этих выводах, мукозит должен рассматриваться как показатель риска развития периимплантита, и при лечении следует ориентироваться на механическую обработку очага воспаления в сочетании с оптимальной индивидуальной гигиеной полости рта у пациента.
Периимплантит
Классическая концепция нехирургического лечения заболеваний пародонта включает обработку корневой поверхности зуба с использованием механических инструментов, оптимальную индивидуальную гигиену полости рта и регулярную поддерживающую терапию.
На основании того, что и пародонтит и периимплантит имеют сходные этиологические факторы, эта концепция может вполне применяться и для нехирургического лечения периимплантита.
Однако только механическая обработка без каких либо дополнительных лечебных воздействий при лечении периимплантита показывает, судя по обзорам клинических наблюдений ограниченную эффективность.
Для того чтобы достичь разрешения воспаления и остановить дальнейшую потерю костной массы, деконтаминация поверхности имплантата имеет решающее значение. Однако деконтаминация поверхности имплантата гораздо сложнее технически, чем обработка поверхности зубов.
Выводы, сделанные из анализа серии клинических случаев, показывают, что механическая обработка поверхности импланта в сочетании с обработкой карманов 0,5% раствора хлоргексидина и дополнительной системной терапией орнидазолом в течение 10 дней, дают положительные клинические и микробиологические результаты в течение 12 месяцев после проведенного лечения. Аналогично положительные результаты с точки зрения клинической картины и микробиологии получены после нехирургической терапии периимплантита при местной обработки хлоргексидином или при механической обработке в сочетании с антибиотиками.
Результаты рандомизированного клинического исследования показали, что у пациентов с высоким уровнем индивидуальной гигиены после механической обработки в дополнении с фотодинамической терапии или местным применением антибиотиков, получены сопоставимые улучшения при лечении начального периимплантита в отношении клинических, микробиологических параметров через 6 и 12 месяцев. Полное разрешение процесса воспаления слизистой оболочки, однако, обычно не достигалось либо использовалась дополнительная фотодинамическая терапия или требовалось местное применение антибиотиков.
Улучшение клинических параметров после нехирургического лечения периимплантита также отмечалось после дополнительной деконтаминации поверхности импланта с использованием воздушно-абразивных аппаратов, диодного или эрбиевый лазера.
Однако следует ожидать ограниченных и непредсказуемых результатов должны после нехирургической механической деконтаминации поверхности имплантата с дополнительными методами лечения или без них. Следовательно, в случаях средне-тяжелого и запущенного периимплантита, нехирургическая терапия может не дать ожидаемого успешного результата, и показаны хирургические методы лечения.
Фотодинамическая терапия при лечении пародонтита и периимплантита
Фотодинамическая терапия, также называемая противомикробной фотодинамической терапией, фоторадиакционной терапией, фототерапией, фотохимиотерапией, фото‐активируемой дезинфекцией или свет‐активированной дезинфекцией, впервые введена в медицинскую практику в 1904 как метод инактивации клеток, микроорганизмов или молекул с применением света. Фотодинамическая терапия включает в себя использование видимого света, как правило, с помощью диодного лазера и фотосенсибилизатора (вещество, способное поглощать свет определенной длины волны и преобразовывать его в полезную энергию). Эти компоненты фотодинамической терапии безвредны, когда используются по отдельности, но в совокупности они приводят к формированию цитотоксических агентов, способных избирательно разрушать клетки.
В последнее десятилетие фотодинамическая терапия была предложена как потенциальная альтернатива для лечения инфекций, вызванных микроорганизмами. Механизм действия основан на обработке фотосенсибилизатора, которая переходит из своего основного в триплетное состояние ,приводящее к генерации цитотоксических соединений, обычно синглетного кислорода , который в свою очередь взаимодействует с окружающими молекулами и клетками. Поскольку синглетный кислород не может мигрировать дальше 0,02 мкм, он имеет только местное влияние и не повреждает дистантные клетки или органы.
Несколько исследований in vitro показали, что свет от различных типов лазера, включая гелий / неоновый или галлий-алюминий-арсенидовый в сочетании с соответствующими фотосенсибилизаторами могут значительно снизить численность и жизнеспособность как аэробных, так и анаэробных бактерий и признаки воспаления.
Результаты клинических исследований свидетельствуют о том, что у пациентов с хроническим пародонтитом, применение фотодинамической терапии после поддесневого SRP приводит к статистически значимому клиническому улучшению, о котором свидетельствуют уменьшение глубины зондирования и / или кровоточивости в сравнении с только SRP.
Однако, у пациентов с агрессивными течением пародонтита дополнительное применение фотодинамической терапии дало меньшее клиническое улучшение по сравнению с системным применение амоксициллина и метронидазола.
В настоящее время, нет данных, сравнивающих применение фотодинамической терапии и системной антибиотикотерапии для пациентов с хроническим пародонтитом.
Результаты одного рандомизированного контролируемого клинического исследования указывают, что фотодинамическая терапия может представлять собой возможную альтернативу местному назначению антибиотиков у пациентов с легкой формой периимплантита.
Имеющиеся данные показывают, что фотодинамическая терапия может рекомендоваться в поддерживающей пародонтальной терапии или терапии в области имплантов, но ее следует использовать только в сочетании с поддесневой механической обработкой. Однако в настоящее время применение фотодинамической терапии не может быть рекомендовано в качестве альтернативы системным антибиотикам при лечении агрессивного пародонтита или тяжелых случаев хронического пародонтита.
Материал «Nonsurgical therapy for teeth and implants—When and why?» Niklaus P. Lang, Giovanni E. Salvi & Anton Sculean выполнен для проекта «Современная пародонтология»
