В последние десятилетия оценка рисков стала предметом пристального внимания в клинических исследованиях. Было разработано и в разной степени апробировано несколько инструментов оценки пародонтальных рисков (Heitz-Mayfield, 2005; Lang, Suvan, & Tonetti, 2015).
На 11-м Европейском пародонтологическом семинаре (2015) были рассмотрены пять инструментов оценки риска (Lang et al., 2015). Из 5 моделей оценки был выделен один — Periodontal Risk Assessment (PRA) (Lang & Tonetti, 2003), который был подтвержден в 9 международных исследованиях.
Все эти исследования показали, что пациенты с высоким риском повторного инфицирования тканей пародонта и прогрессированием заболевания после активного лечения пародонта можно было определить, используя 6 критериев PRA.
Эти критерии обобщены на шестиугольной функциональной диаграмме, которая разделяет пациентов на группы с низким, умеренным или высоким риском. PRA находится в открытом доступе на 23 языках. Следовательно, PRA широко используется профессионалами с частотой более 500 обращений в день.
Поскольку этиологии и патогенезу периимплантных заболеваний уделяется все большее внимание, настало время разработать аналогичный инструмент оценки риска для прогнозирования развития периимплантита. Оценка риска заболеваний вокруг имплантов (IDRA) используется с целью минимизации вероятности развития разрушения тканей вокруг имплантатов. Понимая ключевые факторы, связанные с развитием периимплантных заболеваний, задокументированных в литературе, клиницист может учитывать такие факторы для улучшения результатов лечения. IDRA может быть использован для оценки риска как у пациентов с полным отсутствием зубов, так и у пациентов с частичным отсутствием зубов. Однако у первых могут быть некоторые ограничения.
Анализ результатов недавних исследований, посвященных факторам риска/индикаторам осложнений, связанных с зубными имплантами, выявил восемь важных факторов, которые могут способствовать развитию периимплантита. С другой стороны, контроль таких факторов позволил бы свести к минимуму вероятность развития осложнений.
Что касается PRA, то не существует ни одного фактора, который можно было бы отнести к развитию периимплантного заболевания.
Путем анализа текущей литературы были определены следующие 8 параметров:
1. Пародонтит в анамнезе
2. Процент участков с кровоточивостью (BOP%)
3. Распространенность PD (глубина зондирования) ≥ 5 мм.
4. Потеря костной массы относительно возраста пациента.
5. Наличие пародонтита и его степень тяжести и стадия по классификации заболеваний пародонта и периимплантных заболеваний 2017 года (Tonetti, Greenwell, & Kornman, 2018)
6. Поддерживающая терапия пародонтита
7. Расстояние от края протеза с опорой на имплант до края костной ткани
8. Факторы, связанные с протезированием на имплантах
Эти восемь параметров были объединены в восьмиугольник, который визуализирует риск развития заболевания. Всесторонняя оценка с использованием этой функциональной диаграммы обеспечит индивидуальный общий профиль риска и определяет необходимость мер, направленных на его снижение. Каждый вектор или ось имеет свою собственную шкалу профилей риска. Поскольку дополнительные факторы продолжают выявляться из литературы, могут потребоваться изменения данной диаграммы.
Имеются неопровержимые доказательства того, что бактериальные биопленки являются наиболее важными этиологическими агентами для инициации и прогрессирования периимплантных заболеваний (Berglundh et al., 2018). Исследования, оценивающие самостоятельный контроль зубного налета, показали сильную связь с плохим уровнем гигиены и периимплантитом (Schwarz, Derks, Monje, & Wang, 2018).
У пациентов с пародонтитом в анамнезе частота периимплантных заболеваний была выше, когда общий показатель зубного налета (FMPS) превышал 25% (Aguirre-Zorzano, Estefania-Fresco, Telletxea, & Bravo, 2015). Однако исследования еще не определили уровень контроля биопленки, совместимый с поддержанием здоровья после имплантации. Кроме того, оценка гигиены, полученная в один момент времени, может не отражать обычный уровень самостоятельного уровня гигиены у пациента. Реакция организма хозяина на биопленку считается более важной, чем оценка биопленки как таковой; следовательно, уместно соотнести эту оценку с показателями воспаления — кровоточивостью при зондировании в процентах (BOP %). Следовательно, процент BOP, а не FMP как индекс гигиены, включен в качестве параметра в диаграмму оценки рисков.
Оценка рисков периимплантита. Обзор
Пародонтит в анамнезе
В результате исследований получены убедительные доказательства того, что пациенты с пародонтитом в анамнезе подвержены периимплантиту (Derks et al., 2016; Karouss et al., 2003; Kordbacheh Changi, Finkelstein, & Papapanou, 2019; Roccuzzo, De, Angelis, Bonino, & Аглиетта, 2010). Следовательно, пациент, у которого в анамнезе был пародонтит или который потерял зубы, подлежащие замене имплантами, по причине пародонтита, подвергается высокому риску. Напротив, пациент, потерявший зубы из-за кариеса, травмы, подвержен более низкому риску. Историю пародонтита можно уточнить, оценив потерю костной массы на рентгенограммах или изучив стоматологическую карту пациенту, чтобы определить причину потери зубов. Пациент также может быть в состоянии самостоятельно указать причину потери зуба.
Процент участков с признаками кровоточивости (BOP %)
Кровотечение при мягком зондировании представляет собой объективный параметр воспаления, который был включен в системы индексов для оценки состояния тканей пародонта (Löe & Silness, 1963; Mühlemann, 1973) и периимплантных тканей (Mombelli, van Oosten, Schürch, & Lang, 1987). Процент участков с кровоточивостью также может быть использован в качестве параметра индивидуальной оценки, представляющего реакцию хозяина на бактериальную инфекцию.
Включение % BOP в PRA установило распространенность BOP в 25% в качестве точки отсечения между пациентами, которые сохраняли стабильность пародонта в течение 4 лет, и пациентами с рецидивирующим заболеванием в тот же период времени (Joss, Adler, & Lang, 1994; Matuliene et al., 2008). Дополнительные доказательства того, что % BOP (в диапазоне от 20% до 30%) определяет более высокий риск прогрессирования заболеваний пародонта, были продемонстрированы в ряде исследований (Badersten, Nilveus, & Egelberg, 1990; Claffey, Nylund, Kiger, Garrett, & Egelberg, 1990; Matuliene et al., 2008)
Также было показано, что кровотечение при зондировании в местах, где установлены импланты, связано с прогрессированием заболевания (Karlsson et al., 2019; Luterbacher, Mayfield, Brägger, & Lang, 2000; Giovanni Serino & Turri, 2011). Таким образом, процент BOP используется в качестве второго показателя риска в диаграмме IDRA.
На шкале имеются отметки 9, 16, 25, 36 и >49%. Оценка включает в себя % BOP во всех точках, где располагаются зубы и импланты. Пациенты с низким % BOP (<10%) могут рассматриваться как пациенты с низким риском развития заболевания (Lang, Adler, Joss, & Nyman, 1990), в то время как пациентов с % BOP >25% следует рассматривать как подверженных более высокому риску деструкции тканей.
Глубин зондирования ≥5 мм
Большое количество глубоких пародонтальных карманов (PD ≥ 5 мм) и увеличение глубины зондирования во время циклов поддерживающей терапии связано с высоким риском прогрессирования заболевания пародонта (Badersten et al., 1990; Claffey et al., 1990). Также было показано, что предполагаемые пародонтопатогены из глубоких остаточных карманов на зубах могут колонизировать места имплантации (Mombelli, Marxer, Gaberthuel, Grunder, & Lang, 1995 ).
Кроме того, наличие большего количества остаточных карманов было связано с развитием периимплантита не только в среднесрочной перспективе (Cho-Yan Lee, Mattheos, Nixon, & Ivanovski, 2012) , но и в долгосрочной (Pjetursson et al., 2012). При оценке риска развития периимплантых патологий количество участков, включая зубы и импланты, где глубина зондирования- PD ≥ 5 мм оценивается как третий показатель риска на функциональной диаграмме IDRA. Шкала имеет отметки 2, 4, 6, 8, ≥10. Пациенты с 1-2 участками, где PD ≥ 5 мм могут рассматриваться как пациенты с низким риском, в то время как пациенты с более чем 6 участками с PD ≥ 5 мм рассматриваются как пациенты с высоким риском развития осложнений.
Потеря костной массы в зависимости от возраста
Степень и распространенность потери прикрепления тканей пародонта, оцениваемая по высоте альвеолярной кости на рентгенограммах, может представлять собой наиболее очевидный показатель оценки риска прогрессирования заболеваний пародонта у пациента в зависимости от его возраста (Papapanou, Wennström, & Gröndahl, 1988).
Потеря костной массы была определена как фактор риска развития периимплантных заболеваний в 2 крупных рандомизированных популяционных исследованиях (Derks et al., 2016; Kordbacheh Changi et al., 2019). Таким образом, степень потери альвеолярной костной ткани в зависимости от возраста пациента оценивается как четвертый показатель риска развития заболевания на функциональной диаграмме IDRA.
Оценка потери альвеолярной кости выполняется как на периапикальных рентгенограммах, где ведется приблизительный подсчет потери в процентах относительно длины корня, так и на рентгенограммах в прикус, где оценка потери костной массы выражается в мм. На рентгенограммах в прикус считается, что 1 мм равен 10% потере костной массы.
Затем процент делится на возраст пациента, в результате чего получается коэффициент.
В качестве примера- 40-летний пациент с потерей костной массы около 20% получает индекс = 0,5. Другой 40-летний пациент с 50%-ной потерей костной массы набрал бы 1,5.
Шкала рассчитана с шагом 0,25, при этом 0,5 является критическим значением для разделения низкого и умеренного риска, а 1,0 — значением для умеренного и высокого риска. Это, в свою очередь, означает, что пациент, потерявший больший процент альвеолярной кости, чем его / ее возраст, подвергается высокому риску в отношении этого показателя при многофакторной оценке.
Наличие пародонтита и его степень тяжести и скорость прогрессирования заболевания
В 2017 году на семинаре, посвященном вопросу классификации заболеваний пародонта и периимплантных состояний была предложена новая система классификации заболеваний пародонта, охватывающая степень, тяжесть и сложность в зависимости от стадии (Tonetti et al., 2018). Кроме того, скорость прогрессирования и, следовательно, восприимчивость к заболеванию были включены в методику оценки (Tonetti et al., 2018).
Поэтому представляется логичным добавить стадию и степень заболеваний пародонта в качестве отдельной шкалы для оценки влияния на развитие и прогрессирование периимплантных заболеваний.
Согласно IDRA, только 1 стадия А соответствует низкому риску. Стадия 2 представляет умеренный (от среднего узла в умеренном диапазоне диаграммы) или более высокий риск. Стадия 3 представляет умеренный (от внешнего узла в умеренном диапазоне диаграммы) или более высокий риск. Стадия 4 представляет высокий риск. Что касается классификации: класс В представляет умеренный (от среднего узла в умеренном диапазоне диаграммы) или более высокий риск, а класс С всегда представляет высокий риск.
Количество зубов, которые были потеряны из-за пародонтита, включено в определение стадии по классификации 2017 года.
Поскольку доказательства связи с периимплантитом остаются неоднозначными в отношении курения сигарет и сахарного диабета, эти модифицирующие факторы рассматриваются как потенциальные или возможные индикаторы риска (Schwarz et al., 2018). Таким образом, они не представлены в IDRA отдельной шкалой; вместо этого они включены в классификацию заболеваний пародонта 2017 года.
Эта классификация относит некурящего пациента к классу А (медленный темп прогрессирования), курильщик Пациенту, у которого диабет не диагностирован, присваивается степень А (медленная скорость прогрессирования). Пациент с сахарным диабетом и HbA1c < 7,0% имеет степень B (умеренная скорость прогрессирования), а HbA1c ≥ 7,0% — степень C (быстрая скорость прогрессирования).
Поддерживающая пародонтальная терапия (SPT)
Имеются убедительные доказательства того, что регулярная система вызова пациента, где проводится соответствующая поддерживающая терапия, имеет первостепенное значение для здоровья и стабильности периимплантной зоны (Costa et al., 2012; Monje et al., 2016; Roccuzzo, Bonino, Aglietta, & Dalmasso, 2012). Таким образом, шестой вектор\ось в диаграмме IDRA касается комплаентности пациентов к поддерживающей помощи, оказываемой клиницистом. Очевидно, что отсутствие поддерживающей терапии представляет высокий риск развития периимплантного заболевания, в то время как полное соблюдение рекомендованного и рассчитанного интервала поддерживающей терапии приводит к низкому риску развития заболевания. Систематический обзор (Monje et al., 2016) определил, что интервал вызова, составляющий в среднем менее 5 месяцев или равный им, может представлять собой временные рамки, совместимые с поддержанием здоровья в периимплантых тканях.
Расстояние от края протеза с опорой на имплант до края костной ткани
Крупное популяционное исследование выявило, что расстояние ≤1,5 мм от края протеза с опорой на имплант до края костного гребня во время протезирования является показателем риска развития периимплантита (Derks et al., 2016). Следовательно, важно учитывать это расстояние при оценке риска развития заболевания.
В то время как имплант на уровне мягких тканей обычно имеет надслизистый край и, следовательно, дает низкий риск развития заболевания, было продемонстрировано, что расстояние от края протеза до костного гребня ≤1,5 мм сопряжено с более высоким риском.
Таким образом, функциональная диаграмма IDRA определяет низкий риск для имплантата на уровне мягких тканей, умеренный риск, если расстояние 1,5 мм и высокий риск, если расстояние <1,5 мм. Это определяется по рентгенограмме, сделанной во время ортопедического лечения. Если рентгенограмма во время установки протеза недоступна, рентгенограмму следует сделать во время осмотра и оценки риска.
Факторы, связанные с протезированием на имплантах
Несколько исследований показали, что дизайн и контуры протеза с опорой на имплантат могут привести к появлению трудно очищаемых участков. Следовательно, это способствует накоплению и росту биопленки и это может инициировать периимплантное заболевание (Serino & Ström, 2009). Кроме того, ятрогенные факторы, такие как плохое прилегание краев и подслизистые остатки цемента, обеспечивают среды обитания для биопленки и, следовательно, являются подтвержденными факторами развития осложнений.
Недавно это было подтверждено в крупном популяционном исследовании (Kordbacheh Changi et al., 2019). Чтобы обеспечить низкий риск развития заболевания, протез должен хорошо прилегать, поддаваться очистке, иметь винтовую фиксацию или без избытка цемента. И наоборот, не поддающийся очистке, плохо припасованный протез подвержен высокому риску накопления биопленки и, следовательно, развивается периимплантное заболевание. То же самое относится и к наличию избытков цемента. Умеренный риск может быть связан с протезом, который имеет нарушенную посадку, но доступные для обработки надслизистые края. В контексте IDRA термин «поддающийся очистке\гигиене» относится как к доступу для очистки протеза для врача, так и для пациента. Способность пациента при этом будет зависеть от его уровня мануальных навыков, которые со временем могут меняться.
Функциональная схема оценки рисков заболеваний периимплантной зоны (IDRA)
Каждая ось представляет один параметр риска с относительной шкалой внутри каждого параметра. При совокупной оценке факторов низкий риск представлен областью в центре восьмиугольника (зеленая штриховка). Умеренный риск обозначен областью восьмиугольника между первым и вторым кольцами, выделенной жирным шрифтом (желтая штриховка). Высокий риск представляет область за пределами второго жирного кольца восьмиугольника (красная штриховка).
Параметры (на картинке ниже):
1.Пародонтит в анамнезе (да/нет)
2.BOP % (кровоточивость при зондировании) — процент участков (импланты и зубы) с положительным BOP
3.PD (глубина зондирования) ≥ 5 мм — количество участков с PD ≥ 5 мм на имплантах и зубах
4.BL(потеря костной массы)/ возраст — потеря костной массы в зависимости от возраста пациента. Потеря костной массы оценивается по периапикальной рентгенограмме или снимку в прикус в наиболее сильно пораженных зубах — на периапикальных рентгенограммах оценка потери производится относительно расстояния от апекса до точки, лежащей апикальнее на 1 мм цементно-эмалевого соединения; на рентгенограммах в прикус % потери альвеолярной костной ткани рассчитывается из расчета 10% = 1 мм
5.Наличие заболеваний пародонта – оценка проводится в соответствии с классификацией, принятой на Международном конгрессе по классификации заболеваний пародонта в 2017 года (Tonetti et al., 2018)
6.Поддерживающая пародонтальная терапия SPT (рекомендуемый интервал вызова ≤5 месяцев, интервал вызова 6 месяцев, случайные посещения, без поддерживающей терапии)
7.Расстояние от края протеза с опорой на импланты до костной ткани (имплант на уровне мягких тканей, >1,5 мм, <1,5 мм). Это определяется по рентгенограмме
8.Оценка факторов, связанных с к протезу с опорой на импланты (поддается гигиене, плохо прилегает к надслизистым краям, плохо прилегает к подслизистым краям, избыток цемента, не поддается гигиене)
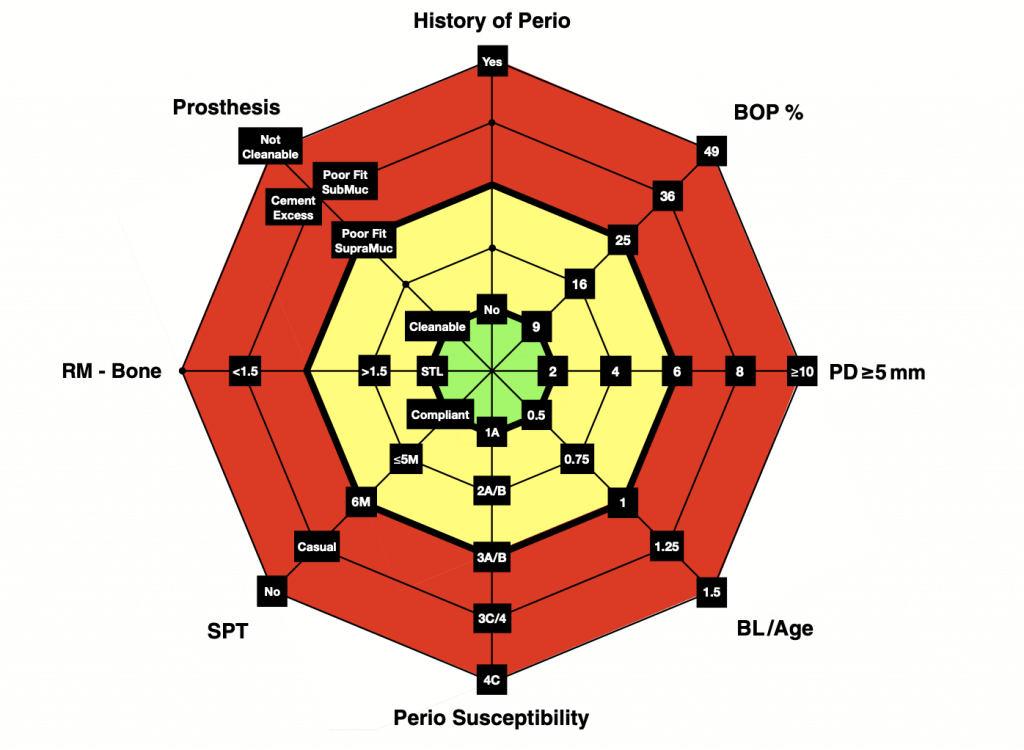
Расчет индивидуальной оценки рисков развития периимплантых заболеваний - IDRA
На основе восьми параметров, указанных выше, для IDRA строится многофункциональная диаграмма (восьмиугольник). На этой диаграмме оси сформированы на основе имеющихся научных данных. При этом возможны незначительные изменения в текущей диаграмме.
Пациент с низким уровнем IDRA имеет все параметры в категории низкого риска или не более одного параметра в категории умеренного риска.
Пациент со средним уровнем IDRA имеет по крайней мере два параметра в категории умеренного риска, но не более одного параметра в категории высокого риска. У пациентов со средним риском IDRA может быть один параметр в категории высокого риска, при этом все остальные параметры относятся к категориям низкого риска.
Пациент с высоким риском IDRA имеет по крайней мере два параметра в категории высокого риска.
У пациентов из группы высокого риска, у которых наблюдается высокий %BOP и большое количество остаточных карманов (PD ≥ 5 мм), риск развития периимплантной патологии может быть снижен до умеренной степени IDRA, если будет проведена дальнейшая успешная пародонтальная терапия. В то время как эти два параметра (%BOP, PD ≥ 5 мм) легко изменяются с помощью специальной терапии, другие параметры, такие как припасовка протеза, могут потребовать замены протеза.
Один из факторов в IDRA диаграмме, а именно история пародонтита, не может быть изменена и поэтому должна приниматься как данность. Компенсация этого высокого риска может быть достигнута путем минимизации влияния других параметров.
У пациентов с полным отсутствием зубов, где проведено восстановление произведено с помощью протеза с опорой на импланты, где история пародонтита не может быть определена, этот параметр не оценивается. Кроме того, у такого пациента невозможно назначить параметр потеря костной массы относительно возраста. Если у такого пациента в анамнезе был пародонтит оценка риска по параметру “пародонтит в анамнезе” должна быть присвоена как высокая.
Данный инструмент оценки рисков IDRA потребует подтверждения с помощью ретроспективных или проспективных исследований в различных частных клиниках и университетах.
В заключение необходимо отметить, что IDRA потенциально может стать полезным инструментом для оценки риска для отдельного пациента после протезирования с опорой на импланты. Кроме того, IDRA может быть полезен в качестве контроля для выявления изменяемых факторов рисков до начала имплантации и в качестве инструмента для врача, позволяющего информировать пациента об уровне рисков.
Перевод статьи «Implant Disease Risk Assessment IDRA–a tool for preventing peri-implant disease» Lisa J. A. Heitz-Mayfield, Fritz Heitz, Niklaus P.Lang, 2020
