Профилактика направлена на предупреждение заболевания в отличие от его лечения. Первичная профилактика включает укрепление здоровья и защиту от рисков; вторичная профилактика включает процедуры выявления и устранения ранних стадий заболевания; третичные профилактические мероприятия нацелены на коррекцию повреждений, причиненных болезнью, и направлены, прежде всего на поддержание или улучшение остаточных функций.
В этом материале мы сосредоточимся на профилактических мерах, принимаемых либо после завершения активной пародонтальной терапии, либо после дентальной имплантации. В этих ситуациях здоровье, болезнь и утрата функций — это состояния, которые не всегда четко различимы. Поскольку они зависят от определений того, что представляет собой заболевание, трудно отличить истинную профилактику от лечения постоянного или рецидивирующего заболевания, отсюда и термин «поддерживающая терапия». Такие установленные различия могут казаться не имеющими практических последствий, но это актуально при обсуждении экономической эффективности профилактических мер здравоохранения. Вопреки распространенному мнению для некоторых заболеваний на самом деле более эффективно ждать симптомов, чем действовать превентивно. Например, сообщалось, что расходы на медикаменты и диетические вмешательства для снижения высокого уровня холестерина в крови превышают затраты на лечение сердечно-сосудистых заболеваний: первичная профилактика имела благоприятное соотношение затрат и эффективности только в подгруппах с конкретными группами риска.
В контексте данного обзора можно спросить: «Как влияет отсутствие дентальной биопленки на содержание программы поддерживающей терапии с акцентом на карманах >4мм с кровотечением или нагноением после зондирования?». Вообще говоря, меры наиболее ценные для изучения и инвестирования те, которые обещают существенную пользу для здоровья при разумных затратах для значительной части населения. Однако на индивидуальном уровне первичная профилактика может восприниматься как инвестиция в качество жизни. Кроме того, поддерживающая терапия после обширного лечения пародонта и имплантации может иметь лучшее соотношение затрат и эффективности, чем первичная профилактика из-за наличие специфических рисков.
Поддерживающая терапия после завершения активной пародонтальной терапии и после дентальной имплантации состоит из трех компонентов:
- меры, принимаемые пациентом: личная гигиена полости рта; избегание экологических рисков, таких как табачный дым; и управлениесистемными заболеваниями, такими как диабет;
- профилактические процедуры, проводимые профессиональным стоматологом: удаление наддесневых отложений и полировка, устранение факторов ретенции зубного налета, таких как дефектные или плохо подходящие реставрации;
- «поддерживающая пародонтальная терапия» в узком смысле: вмешательства, направленные на устранение причины, патологических механизмов или последствий рецидивирующего или остаточного заболевания, таких как субгингивальная биопленка, воспаление или подвижность зубов.
Этиология пародонтита и периимплантита: поддерживающая терапия и ее значение
Пять доказательств показывают, что бактериальные биопленки на поверхности зубов и имплантатов играют доминирующую роль в развитии и прогрессировании пародонтита и периимплантита:
- эксперименты с участием людей показали, что накопление бактериального зубного налета на зубах и имплантатах в течение нескольких дней вызывало воспаление в прилежащей десне («экспериментальный гингивит», первоначально описанный Löe) и периимплантый мукозит;
- перекрестные исследования выявили четкие количественные и качественные различия в микробиоте здоровых и пораженных тканей пародонта или периимплантных тканей;
- в экспериментах на животных субгингивальное размещение лигатур вокруг зубов и имплантатов вызывало сдвиги в составе местной микробиоты с последующим разрушением тканей пародонта и периимплантных тканей;
- исследования у пациентов с пародонтитом или периимплантитом показали положительные эффекты механического удаления биопленки и улучшения результатов после терапии антибиотиками в дополнении к основному лечению;
- долгосрочные наблюдения после пародонтальной терапии показали, что плохие результаты часто ассоциировались с наличием большого количества зубного налета. На основании этих данных предлагаются следующие требования для поддержания состояния тканей пародонта и установленных имплантатов;
- необходимо избегать скопления большого количества бактерий на зубах и имплантатах, чтобы предотвратить воспаление десны и слизистой оболочки вокруг имплантата;
- необходимо устранить или контролировать местные экологические факторы, которые способствуют росту потенциально патогенных микроорганизмов вокруг зубов и имплантатов;
- удаление бактериальных отложений на зубах и имплантатах — важный шаг в лечении пародонтальных и периимплантных инфекций.
Хотя первичная этиологическая роль бактерий общепризнана, в последние годы стало ясно, что разрушение тканей, наблюдаемое при пародонтите и, возможно, также при периимплантите, может быть связано в основном с нарушением регуляции воспалительных механизмов и неадекватными иммунными реакциями на присутствие бактерий. Эти реакции и их последствия могут быть весьма разными среди людей с течением времени и даже от места к месту у одного человека. Сообщалось, что у монозиготных и дизиготных близнецов, выращенных вместе, примерно половину фенотипической изменчивости заболевания пародонта у взрослых можно отнести к наследственным факторам. Тем не менее, исследования не смогли идентифицировать отдельные генетические факторы, оказывающие сильное и воспроизводимое влияние на восприимчивость к пародонтиту или периимплантиту.
Изменение местных экологических условий могут вызывать экспрессию факторов вирулентности или способствовать изменению состава эндогенной микробиоты, которая может стать непереносимой для тканей хозяина. С другой стороны, изменения в локальной среде могут вызывать реакции в тканях хозяина, которые, в свою очередь, могут вызывать изменения в микробиоте. Смешанные анаэробные инфекции, возникающие после размещения субгингивальных лигатур вокруг зубов или зубных имплантатов или при наличии избытка цемента на подслизистой поверхности имплантата, могут быть ослаблены антимикробными агентами. Однако остановка деструктивного патологического процесса в ткани требует полного удаления инородного тела. Как следствие, дифференциальный диагноз первичных или рецидивирующих инфекций пародонта и периимплантных тканей должен включать поиск возможного основного триггера, даже если гноетечение или микробиологический тест, положительный для анаэробных бактерий, указывают на бактериальную причину.
Возможные факторы риска заболеваний пародонта были тщательно изучены. Список модифицирующих факторов риска при пародонтите включает (но не ограничивается ими): курение, диабет, стресс и социально-экономический статус. Степень доказательности для того, чтобы рекомендовать вмешательство как часть пародонтальной терапии и поддерживающую терапию для контроля таких факторов, является переменной. Углубленное обсуждение выходит за рамки этого материала. Наилучшие доказательства существуют для такого фактора как курение. Сюда включаются многофакторный анализ, определяющий курение как независимый риск потери пародонтального прикрепления в зависимости от дозы курения, продольные исследования, демонстрирующие временную последовательность воздействия болезни, интервенционные исследования, показывающих различные результаты лечения пародонтита в зависимости от статуса курения, доказательства положительного влияния прекращения курения на возникновение пародонтита и заживление пародонта и долгосрочные наблюдения, показывающие более высокий риск рецидива заболевания у курильщиков.
В систематическом обзоре, где проанализировано состояние 50 курящих пациентов, было установлено, что возраст и первоначальный прогноз связаны с потерей зуба при длительном поддерживающем пародонтальном лечении. Возможные факторы риска для осложнений в области имплантатов также были оценены. Курение табака и пародонтит в анамнезе были связаны с более высокой распространенностью периимплантита и повышенным риском потери имплантата.
Общие доказательства преимуществ поддерживающей терапии
Исследования, проведенные в 1980-х годах, убедительно продемонстрировали, что долгосрочная стабильность после пародонтальной терапии возможна, если пациенты соблюдают правила гигиены полости рта, и они включены в регулярную программу поддерживающей терапии. И наоборот, исследования того времени также продемонстрировали, что без эффективной гигиены полости рта и без поддерживающего ухода положительный эффект от различных видов лечения пародонта исчезнет. Влияние лояльности пациента на потерю зубов во время поддерживающей пародонтальной терапии было подтверждено недавно систематическим обзором и метаанализом.
Тип и частота поддерживающего лечения могут влиять на заболеваемость и тяжесть рецидивов заболеваний пародонта и осложнения в области зубных имплантатов. 43 пациента с прогрессирующим заболеванием пародонта были проинформированы о важности зубного налета в этиологии заболеваний пародонта. После хирургического лечения они осматривались каждые 6 месяцев, но профессиональная поддерживающая терапия не оказывалась. Клинические и рентгенологические результаты после 4 лет показали, что хорошая гигиена полости рта была более важна, чем регулярное профессиональное вмешательство. Одно исследование показало, что строгая программа вызова пациентов на осмотр в течение первых 6 месяцев после терапии, с посещениями каждые 2 или 4 недели и последующим поддерживающим лечением с интервалом в 3 месяца, дала результаты лучше, чем просто 3-месячная программа поддерживающего лечения. Другое исследование показало, что пациенты, включенные в программу таких вызовов с интервалом в 2 месяца между посещениями в течение 2 лет и 3-месячным интервалом после имели явно лучше состояние пародонта за 6 лет, чем пациенты, направленные обратно к стоматологам только для поддерживающего лечения. Относительно имплантатов, так как эволюция от периимплантного мукозита к периимплантиту может быть постепенной, поддерживающая терапия может остановить инфекцию до значительного повреждения кости. На самом деле, пациенты, которые были включены в программу поддерживающего лечения в нескольких долгосрочных исследованиях показали случайные симптомы периимплантного мукозита или раннего периимплантита. Незначительные проблемы решались с помощью простых нехирургических вмешательств. У этих пациентов распространенный периимплантит был очень редким исходом.
В другом исследовании с 11% распространенностью периимплантита, периимплантиты никогда не диагностировались у некурящих пациентов без пародонтита в анамнезе и с постоянным наблюдением. Недавний анализ 13 исследований, сообщающих о заболеваемости/распространенности осложнений и практики последующего ухода, показали значительное влияние интервала поддерживающего лечения на заболеваемость периимплантитом.
Поддерживающая терапия и остаточный карман
Даже после наилучшим образом проведенного лечения и подавления активности микрофлоры в пародонтальном кармане не все глубокие поражения предсказуемо превращаются в борозду с физиологической глубиной зондирования. Например, в рандомизированном клиническом исследовании 80 пациентов с пародонтитом от средней до тяжелой степени тяжести, карманы были пролечены нехирургическим и хирургическим способом и системным назначением метронидазола и амоксициллина в течение 7 дней. Через шесть месяцев после окончания активной терапии среднее количество остаточных карманов >4 мм с кровотечением при зондирование составляло 3 на 1 пациента. В другой группе из 172 пациентов, в среднем 4 остаточных кармана >4 мм были на пациента после завершения активной пародонтальной терапии. Продольный микробиологический мониторинг обработанных участков показал, что в основном микроорганизмы, которые присутствовали до терапии, снова обнаруживается после лечения, если не было предпринято никаких мер для подавления образования и созревания новой биопленки. Темнопольная микроскопия была использована в классическом исследовании, чтобы продемонстрировать этот факт после нехирургической механической обработки карманов. Если не было предпринято никаких мер профилактики, большое количество спирохет и подвижных палочек появилось в течение 4-8 недель. Наоборот, у пациентов, которые использовали полоскания два раза в день 0,2% раствором хлоргексидина и получали профессиональную гигиену 1 раз в 2 недели, наблюдается устойчивое, выраженное снижение подвижного сегмента субгингивальной микробиоты.
В другом исследовании состав субгингивальной микробиоты был аналогичен таковому у пардонтально здоровых через 1 неделю после скейлинга и корневое сглаживания — первые признаки сдвига в сторону условий до лечения были замечены через 3 недели, и никаких различий с уровнями до лечения не было видно через 3 месяца. В недавнем исследовании динамических изменений в субгингивальном микробиоме были проанализированы с использованием метагеномного программированияя пациенты с пародонтитом до и после лечения. Последующие клинические обследования из ранее отобранных участков поддерживали предположения о влиянии микробиома на прогрессирование заболевания. В качестве интерпретации этих результатов можно сделать вывод, что регулярные профилактические меры необходимы для поддержания микробиологического состояния, достигнутого при лечении пародонтита. Личная гигиена полости рта мешает формированию супрагингивальной биопленки и решает проблему повторного загрязнения обработанных участков микроорганизмами из полости рта. Эти процедуры, однако, имеют только ограниченное влияние на бактерии, которые либо восстановили доступ к поддесневой области или которые никогда не были полностью удалены оттуда. Таким образом, вмешательство в формирование биопленки в поддесневой области может быть необходимо с интервалами нескольких недель для предотвращения рецидива заболевания в остаточных карманах.
Повторный скейлинг и полировка корней инструментами могут вызывать существенную потерю вещества зуба со временем. Поэтому жизненно важно исследовать и оценивать механические и немеханические альтернативы, которые менее агрессивны, чем использование металлических инструментов, но достаточно эффективны, чтобы удалить неминерализованные субгингивальные бактериальные отложения, которые растут между посещениями поддерживающего лечения. В этом контексте очень важно различать профилактику в смысле контроля биопленки, поддерживающую терапию при «рефрактерных» заболеваниях, вызванных сохранением твердых и прочно прикрепленных остатков (таких как камень), которые превращают поверхность зуба или имплантата в инородное тело, или рецидивирующую инфекцию в результате наличия вирулентных патогенов. Местное применение антибиотика неуместно как профилактическая процедура и не может навсегда вылечить болезнь, осложняющуюся реакцией инородного тела; тем не менее, это может быть вариант для лечения локализованной инфекции.
Искусство дозирования циклов поддерживающей терапии
Профилактика несет в себе риск чрезмерного лечения. В первичной профилактике лечение предоставляется здоровым людям, но не все заболеют, если этого не делать. В будущем персонализированный медицинский подход с использованием генетических и других биологических данных вместе с информацией об анамнезе может помочь адаптировать профилактические меры к индивидуальным рискам людей и изменять протоколы по мере изменения опасностей и рисков. Имеющиеся в настоящее время данные свидетельствуют о том, что этот подход является многообещающим. Тем не менее, современных знаний недостаточно для точных клинических рекомендаций; например, как использовать определенные продукты (и соответствующую дозу) или процедуры на индивидуальной основе. Многомерный анализ данных ретроспективного когортного исследования более 5000 человек выявил связь удаления зубов в течении предыдущих 16 лет с диабетом, курением и количеством профилактических визитов, но не было никаких доказательств того, что генетические тесты для выявления полиморфизма в генах интерлейкина-1 оказали влияние на риск приводящий к удаление зуба. Два ежегодных профилактических визита были полезны для всех пациентов, независимо от результатов генетического тестирования полиморфизма гена интерлейкина 1.
Биологические механизмы, которые связаны с накоплением бактериального налета, находятся под влиянием немодифицируемых факторов и, вероятно, продолжают вести к дисфункции после пародонтальной терапии. Поэтому после пародонтальной терапии регулярные профилактические визиты могут быть необходимы для обеспечения длительного срока стабильности. Как уже упоминалось, трехмесячный интервал вызова обеспечивает стабильность после лечения пародонта почти у всех пациентов, в то время как интервалы более 6 месяцев увеличивают риск рецидива заболевания. Несколько авторов внесли предложения о том, как настроить поддерживающую терапию после пародонтальной терапии в соответствии с риском. Было рекомендовано визуализировать индивидуальный риск рецидива заболевания, используя диаграмму графической паутины, показывающий 6 переменных, потенциально увеличение риска по осям, все начинается с одной точки посередине. Переменные:
- Процент кровотечений при зондировании.
- Количество остаточных карманов >4 мм.
- Количество потерянных зубов.
- Потеря прикрепления в зависимости от возраста пациента.
- Системные и генетические факторы.
- Факторы внешней среды, такие как курение сигарет.
Данные, свидетельствующие о влиянии на риск рецидива заболевания, были представлены для каждого из этих критериев. Площадь сформированного многоугольника после соединения значений данных на каждой оси предполагает общий риск возникновения рецидива заболевания. Относительный вклад каждого фактора (т. е. шкалы на каждой оси), однако, не основан на всестороннем многомерном моделировании, а характер взаимодействия этих переменных может не соответствовать предположению о площади под кривой. Прогностическая ценность оценки риска пародонтита по площади диаграммы относительно долгосрочных результатов лечения была изучена в некоторой степени ретроспективно. Эффективность и действенность этого и аналогичных средств, приспособленных под нужды поддерживающей терапии на индивидуальной основе, не были полностью установлены.
После терапии значение микробиологических тестов для прогнозирования стабильности во время поддерживающего лечения неясна. Некоторые исследования предполагают, что субгингивальное присутствие предполагаемых патогенов, таких как Porphyromonas gingivalis, могут указывать на повышенный риск будущей потери альвеолярной кости. Однако уровни таких бактерий в образцах субгингивального налета легко коррелируют с измеримыми клиническими параметрами, особенно с глубиной зондирования и кровотечение при зондировании, и приписанные риски могут по существу представлять собой риск наличия остаточного кармана. Продольное исследование показало ограниченный потенциал микробиологических тестов, выполненных после нехирургической терапии, для прогнозирования клинического исхода через 6 месяцев, но подтверждало важность хорошей гигиены полости рта, участники все еще имеющие несколько участков с видимой бляшкой после гигиенической фазы, имели повышенную склонность к кровотечению при зондировании через 6 месяцев после скейлинга и полировки. Другое исследование показало, что микробиологические параметры, отражающие бактериальную нагрузку, были более показательны для риска прогрессирования заболевания в течение 2 лет пародонтальной поддержки, чем наличие или отсутствие специфических маркерных организмов.
Матричные металлопротеиназы и другие белки, измеряемые в жидкости зубодесневой борозды, были предложены в качестве биомаркеров для диагностики пародонтита. Взаимосвязь между уровнями этих ферментов и клиническими условиями были зарегистрированы. Продольный мониторинг, показывающий уровень матриксной металлопротеиназы в жидкости зубодесневой борозды, прогнозирует плохие результаты лечения, особенно у курильщиков. Однако из-за высокой вариабельности остаются многочисленные вопросы в полученных результатах, проблемы с методами анализа и интерпретации и отсутствием оценки затрат и выгод.
Очевидно, что больше исследований, оценивающих биологические и клинические аспекты, и оценки вопросов практического использования и экономической ценности, является необходимым для обоснования утверждений об отдельных диагностических критериях, биомаркерах или комбинациях факторов риска в качестве полезных инструментов для адаптации поддерживающей терапии к индивидуальным потребностям.
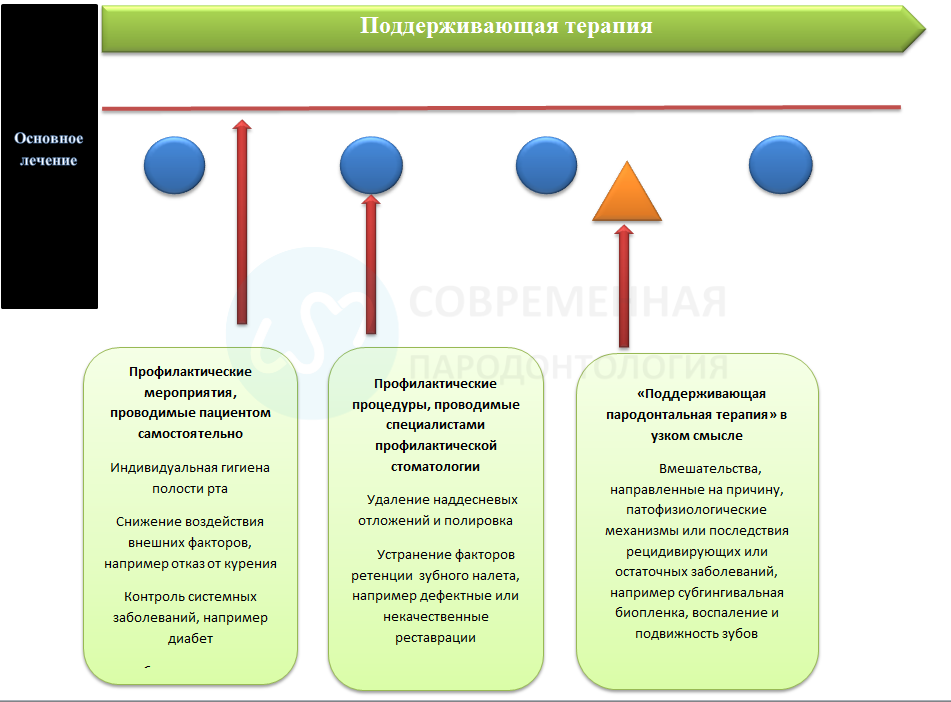
Рис.1. Три компонента поддерживающей терапии после завершения активной пародонтальной терапии и после дентальной имплантации.
Протокол поддерживающего лечения
Диагностические процедуры при поддерживающем лечении не обязательно совпадают с первоначальным обследованием или повторной диагностикой. Время, доступное для этих диагностических манипуляций, как правило, ограничено, и его необходимо использовать эффективно. Повторные диагностические тесты, сделанные во время поддерживающего лечения, должны быть сосредоточены на недавних изменениях в состоянии и новом заболевании. Данные могут касаться пациента в целом, зуба или имплантата, или участка зуба или имплантата. На уровне пациента речь идет о краткой переоценке общего состояния здоровья, приема лекарств или другой терапии, а также истории зубов с момента последнего посещения. Разработанны специальные сокращенные схемы для обозначения состояния. Врачу рекомендуется провести пародонтальное зондирование вокруг каждого зуба и имплантата, но отметить только глубину зондирования >4мм, места кровотечения после зондирования и участки с нагноением или другими признаками активного заболевания. Кроме того, отмечаются дефекты реставраций и кариес. Другими словами, врач осмотрит все участки, но ограничится отметкой участков, нуждающихся в большем внимании, чем просто супрагингивальная гигиена.
Рентгенограммы не должны назначаться как часть планового поддерживающего лечения. Решение сделать выборочные рентгенологические исследования должны основываться либо на вопросе, который остается нерешенным после клинического обследования или рассматривается как неотъемлемая часть повторной диагностики. Согласно действующим официальным рекомендациям следует назначать рентгенограммы только тогда, когда полученные данные могут повлиять на метод лечебного воздействия.
После того, как диагностика завершена, следует рассмотреть каждый из 3 компонентов поддерживающего лечения. Относительно индивидуальной гигиены врач должен обсудить ее результаты с пациентом и использовать эту возможность для мотивации пациента для улучшения практических навыков гигиены полости рта. Инструкции для улучшения гигиены полости рта следует адаптировать к индивидуальной ситуации. Текущие доказательства выступают за мотивирование пациентов в стоматологической практике отказаться от курения. Затем врач должен удалить все мягкие и твердые отложения (налет, камень и пятна) со всех зубов и имплантатов. Важная часть поддерживающей пародонтальной терапии в узком смысле – это контроль поддесневой биопленки в остаточных карманах. Если необходима дополнительная терапия, например, для лечения кариеса или дефекта реставрации, последующее посещение должно быть назначено. В идеальных условиях это должно происходить редко. Поддерживающую терапию не следует путать с санацией пациента. В конце визита необходимо принять решение будет ли интервал вызова пациента изменен или сохранен. Ввиду отсутствия инструментов оценки риска для программирования интервалов вызова, как обсуждалось выше, рекомендуется следующая практика:
- После завершения пародонтальной и/ или имплантационной терапии поддерживающая терапия должна начинаться с периодичностью 3 месяца.
- Стабильность ситуации должна оцениваться постоянно, и частота вызова пациента должна быть адаптирована индивидуально на основе длительного мониторинга. Если пациент имеет адекватный уровень контроля зубного налета и сравнение нынешних с прошлыми измерениями указывает на стабильность, интервал может быть увеличен до 6 месяцев с шагом 1 месяц от посещения к посещению.
- В некоторых случаях высокая частота вызова требуется только из-за наличия высокого местного риска, который затрагивает один зуб или несколько участков. Необходимо оценить насколько целесообразна такая работа по контролю за состоянием скомпрометированного зуба или импланта и каково влияние на здоровые участки зубных рядов. При этом должны быть рассмотрены альтернативные пути решения проблемы.
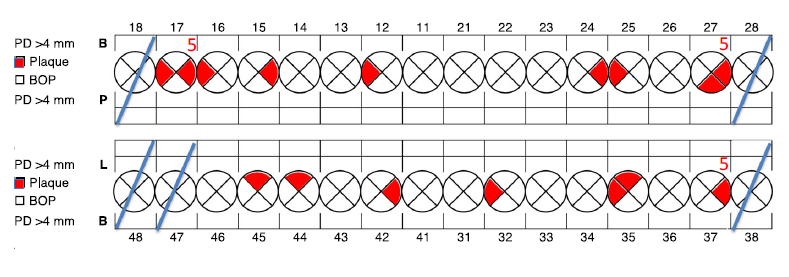
Рис.2. Диаграмма для записи состояния в ходе поддерживающего лечения. Врач при помощи пародонтального зонда исследует борозду вокруг каждого зуба и имплантата, но отмечает только глубину зондирования (PD)> 4 мм, места, которые кровоточат после зондирования (BOP), и участки с нагноением или другими признаками активного заболевания
Поддесневая биопленка в остаточных карманах
Скейлинг и полировка корней (SRP)- это процедура, используемая для удаления бактерий с поверхностей зубов с использованием острых металлических инструментов. Первоначальная пародонтальная терапия направлена на удаление комбинации прочно прикрепленного зубного камня и биопленки. SRP является процедурой с доказанной эффективностью. Однако она не идеальна для контроля биопленки в поддерживающей терапии, потому что каждый раз, когда она проводится, также и удаляется ткань зуба; повторные воздействия могут нанести значительный ущерб твердым тканям. Различные механические и химические альтернативы были предпожены с целью удаления биопленки. Методы дезинфекции пародонтальных карманов включают использование антимикробных препаратов, мазей, гелей и методик для длительного высвобождения лекарственных веществ. Данные о клинических преимуществах получены в основном из рандомизированных клинических испытаний, проверяющие эффективность назначения какого-либо препарата или методики в соотношении с дальнейшим SRP. Протоколы повторных антибактериальных вмешательств для сохранения зубов с остаточными карманами без обширной механической реинструментации, однако, не тестировались тщательно. Так как имеется риск возникновения бактериальной резистентности, повторное лечение местными антибиотиками нежелательно, но другие антимикробные воздействия могут быть вариантом лечения.
Микробиологические и клинические эффекты лака, содержащие 1% хлоргексидин и 1% тимол, применяемые по завершении пародонтальной терапии, были изучены в течение 12 недель. Пока индекс налета значительно увеличился на участках, обработанных лаком плацебо, аналогичного увеличения не наблюдалось на участках тестирования. Незначительные различия в микробиологических параметрах наблюдались между тестом и контролем. Преимущество длительного субгингивального высвобождения хлоргексидина из чипа на основе желатина при поддерживающем лечении пародонтита было изучено у 595 человек, вызываемых с интервалом в 3 месяца на осмотр. При обнаружении остаточной глубины зондирования ≥5мм помещался чип. После 2 лет, остаточные карманы показали среднее уменьшение глубины зондирования на 1мм, у 23% пациентов было как минимум 2 кармана, показывающие уменьшение глубины при зондировании ≥2мм, а глубина зондирования была уменьшена до 4мм с кровотечением при зондировании, тогда как некоторые участки, обрабатываемые только один раз, и еще большее количество участков, обработанных только ультразвуковым инструментом, имели глубину зондирования >4мм с кровотечением при зондировании.
Используя специально разработанную насадку, которая может быть введена в пародонтальный карман, субгингивальная биопленка может быть удалена струей сжатого воздуха, содержащего мелкоабразивный порошок. «Поддесневая воздушная полировка» с порошком глицина была впервые испытана на 50 пациентах с остаточными карманами в рандомизированном клиническом испытании. Лечение хорошо переносилось и было безопасным. В рандомизированном клиническом исследовании продолжительностью 12 месяцев оценивалась повторная субгингивальная полировка с использованием порошка эритрита, содержащего 0,3% хлоргексидина в остаточных карманах. В этом исследовании 50 пациентов находились под наблюдением с интервалом вызова в 3 месяца. На регулярных осмотрах участки, имеющие глубину зондирования >4мм, подвергались субгингивальной воздушной полировке или ультразвуковой обработке. Субгингвальная воздушная полировка уменьшила количество карманов >4мм в той же степени, что и ультразвуковая обработка, но вызвала меньше боли. Между исходным уровнем и 12 месяцами не наблюдалось значительных различий в частотах встречаемости (>1000 и >100000 клеток/ мл) шести видов микроорганизмов. На 12-м месяце тестовые значения были меньше, чем контрольные значения для Aggregatibacter actinomycetemcomitans при> 1000 клеток/ мл, и количество бактерий в тестовых участках никогда не превышало 100000 клеток/ мл.
Поддерживающая терапия в области имплантов
Сохранение высоты маргинальной кости считается решающим для стабильности имплантата. Ранее пороговое значение допустимой убыли в 0,1мм в течение года было предложено в качестве критерия успеха, хотя данное значение ниже разрешающей способности некоторых видов рентгенологического исследования, и оно может быть оценено только арифметически. Диагностические протоколы для поддержания имплантата должны включать чувствительные клинические оценки для выявления признаков инфекции, прежде чем значительная часть поддерживающей кости будет потеряна.
Расстояние между краем мягких тканей и контрольной точкой на имплантате (измерение гиперплазии мягких тканей или рецессии), глубина зондирования, склонность к кровотечению и нагноению могут легко оцениваться с использованием пародонтального зонда. Однако, неясно, указывает ли кровотечение при периимплантном зондировании однократно на повышенный риск периимплантита. Высокая частота кровотечения при зондировании и непропорционально низкая частота клинически проявленного периимплантита в нескольких исследованиях свидетельствует о высокой частоте ложноположительных результатов. Вместо записи да/ нет (выделение крови при зондировании) после того, как зонд полностью погружен, более целесообразно склонность к кровотечению оценивать, используя модифицированный бороздковый индекс кровоточивости (0 — кровотечения нет; 1 — изолированные точки кровотечения; 2 — кровь образует сплошную красную линию; 3 — сильное или обильное кровотечение). Прогрессирование от периимплантного мукозита до периимплантита медленная. Есть, следовательно, возможность на поддерживающей терапии выявить периимплантит на ранней стадии, предотвращая тем самым значительное повреждение периимплантных тканей. Пациенты в нескольких исследованиях были включены в программу поддерживающей терапии, базирующейся на регулярной оценке наличия зубного налета, глубине зондирования, склонности к кровотечению и нагноению. В данном случае периимплантные инфекции были обнаружены и пролечены на ранней стадии. Различные клинические протоколы для профилактики и лечения периимплантита были предложены, в том числе механическая обработка, использование антисептиков и применение местных или системных антибиотиков. Более подробная информация содержится в обзоре Heitz‐Mayfield & Mombelli.
Выводы
Исследования убедительно показали, что долгосрочная стабильность после пародонтальной и имплантационной терапии возможна, если пациенты мотивированы на соблюдение гигиены полости рта, избегают рисков (таких как курение), и включены в программу регулярного поддерживающего лечения. Поддерживающая терапия после завершения активной терапии пародонтита и после дентальной имплантации имеет три компонента:
- меры, принимаемые пациентом;
- предупредительные меры со стороны стоматолога;
- поддерживающая терапия, устраняющая причины или последствия рецидивирующего или остаточного заболевания.
Субгингивальные бактериальные отложения могут не минерализоваться до зубного камня между двумя визитами поддерживающей терапии. Поэтому методы, менее агрессивные чем SRP, могут быть более подходящими для воздействия на остаточные карманы. Повторные клинические оценки, сделанные во время поддерживающей терапии, следует сосредоточить на недавних изменениях в состоянии и появившихся заболеваний. Учитывая отсутствие клинических подтверждений инструментов и методов оценки риска для программирования интервалов повторных вызовов, стабильность ситуации должна оцениваться непрерывно, а частота вызова должна быть адаптирована индивидуально для каждого пациента на основе длительного мониторинга.
Перевод материала «Maintenance therapy for teeth and implants» Andrea Mombelli был выполнена Еленой Сорокиной, автором проекта «Современная пародонтология»
