Поскольку использование дентальных имплантатов продолжает расти во всем мире, растет и частота осложнений, связанных с ними. В ситуациях, когда периимплантит уже вызвал обширную резорбцию кости, стоматолог сталкивается с дилеммой, какое подход к лечению является наиболее подходящим для сохранения имплантата. Известно, что нехирургические методики имеют ограниченную эффективность, в данном материале будет обсуждаться хирургическое лечение периимплантита.
Когда показано хирургическое лечение периимплантита?
Эффективное лечение периимплантита направлено на деконтаминацию инфицированной поверхности имплантата и уменьшение глубины зондирования в области имплантат до ≤5 мм. Для достижения этой цели были предложены различные стратегии, основанные на пародонтальной терапии и включающие в себя как нехирургические методики, так и хирургическое лечение периимплантита.
Несмотря на многочисленные попытки лечения периимплантита с помощью нехирургических методик, таких как механическое удаление отложений или безлоскутные подходы, часто в сочетании с дополнительным назначением антибиотиков или лазерной терапией, клиницисты отмечают ограниченные улучшения клинических параметрах, таких как глубина зондирования в области имплантата (PPD) и кровоточивость при зондировании (BoP). Сложность заключается в получении надлежащего доступа к поверхности имплантатов для тщательной обработки и деконтаминации/ удаления биопленки, особенно в случаях, когда имеется довольно большая глубина кармана и разнообразные особенности дизайна имплантатов.
Согласно клиническим рекомендациям Европейской федерации пародонтологии (EFP), необходимо использовать сначала нехирургические протоколы для улучшения состояния периимплантных мягких тканей, прежде чем рассматривать хирургическое лечение периимплантита.
Хирургическое вмешательство требует тщательной оценки факторов, связанных с пациентом и имплантатом, влияющих в свою очередь на раннее заживление и долгосрочные результаты.
Хирургическое вмешательство обычно включает в себя формирование полнослойного лоскута для доступа к загрязненной поверхности имплантата, при этом проводится удаление грануляций с поверхности мягких тканей и тщательная дезинфекция поверхности имплантата. В течение многих лет были предложены различные ручные инструменты и устройства с электрическим приводом для максимального удаления биопленки и сохранения целостности титана. Однако ни одно устройство, аппарат или инструмент не продемонстрировало превосходство в деконтаминации периимплантной поверхности.
Среди последних разработок – аппарат для электролитной очистки, при использовании которого подается небольшое напряжение на крепление имплантата с одновременной подачей раствора формиата натрия непосредственно на имплантат. Несмотря на многообещающие результаты доклинических и краткосрочных клинических исследований, рутинное использование этого устройства в настоящее время не рекомендуется.
В свете имеющихся данных рекомендуется двойной подход, сочетающий механическую и химическую деконтаминацию, прежде чем оценивать конфигурацию периимплантного костного дефекта. С клинической же точки зрения существуют два основных способа лечения:
- с формированием лоскутов, возможно в сочетании с резекционными методами или имплантопластикой;
- реконструктивные процедуры, направленные на восстановление утраченной костной ткани.
Хирургическое лечение периимплантита: обработка с формированием лоскута без резекционных процедур
Обработка с формированием лоскута включает в себя откидывание слизисто-надкостничного лоскута и последующее удаление грануляций для доступа к контаминированной поверхности имплантата. После удаления грануляционной ткани поверхность имплантата обрабатывается с помощью механических, химических, и, возможно, других вспомогательных методик, таких как фотодинамическая терапии или лазерное воздействие. Затем лоскут укладывается обратно и фиксируется швами. Исследования показали эффективность открытой обработки без резекции, с хорошими показателями выживаемости имплантатов и умеренным достижением целевых показателей (PPD ≤5 мм, отсутствие кровотечения/ нагноения при зондировании, и отсутствие прогрессирующей потери костной ткани) при наблюдении до 5 лет после проведенного лечения. Несмотря на первоначальный успех такого подхода, сохранение хороших долгосрочных результатов все еще проблематично. В других работах сообщалось, что стойкого разрешения заболевания удалось достичь только у 53% имплантатов и 63% пациентов даже в сочетании с системной антимикробной терапией.
Хирургическое лечение периимплантита: обработка с формированием лоскута с резекционными процедурами
В одном крупном исследовании, где анализировался резекционный подход при лечении периимплантита, включающий реконтурирование кости и системную антимикробную терапию, в 54% случаях были достигнуты целевые точки терапии. Однако в 44% имплантатов наблюдался рецидив заболевания или прогрессирование, что привело к их удалению. Примечательно, что статистически значимая корреляция наблюдалась между остаточной глубиной зондирования PPD ≥6мм при наблюдении в течение 1 года и снижением уровня маргинальной кости, что указывает на более высокий риск рецидива или прогрессирования периимплантита. Кроме того, имплантаты с модифицированными поверхностями имели более высокий риск прогрессирования заболевания по сравнению с имплантатами с немодифицированными поверхностями.
Другое долгосрочное ретроспективное когортное исследование продолжительностью до 11 лет показало благоприятные клинические и рентгенографические результаты после хирургического лечения без резекции в сочетании с костным реконтурированием. В исследовании подчеркивалось влияние типа поверхности имплантата, причем сглаженные поверхности дают лучшие результаты, чем модифицированные шероховатые поверхности.
Влияние характеристик поверхности имплантата на выживаемость и успешность хирургического лечения периимплантита освещалось различными авторами. Костная пластика с использованием депротеинизированной бычьей кости с 10% коллагеном в сочетании с пескоструйной обработкой и кислотным травлением показала 80% выживаемость имплантатов по сравнению с 55% -для имплантата с плазменным напылением в течение 7-10-летнего периода наблюдения.
Имплантопластика включает в себя сглаживание надкостных витков имплантатов и открытых шероховатых поверхностей для облегчения удаления биопленки и минимизации ее фиксации в период поддерживающей фазы. Однако современные данные о преимуществах имплантопластики перед другими методами деконтаминации, когда проводится хирургическое лечение периимплантита, неубедительны. В некоторых исследованиях оценивалась эффективность имплантопластики по сравнению с альтернативными методами деконтаминации, например с помощью воздушной полировки глицином. Клинические осмотры и фиксация основных параметров через 3 и 6 месяцев показали схожие результаты в отношении PPD и BoP, что говорит о сопоставимой эффективности между имплантопластикой и обработкой глицином.
Как бы то ни было, относительно имплантопластики есть определенные опасения, включая риски формирования остаточных частиц титана в периимплантных мягких тканях или повышение вероятности перелома имплантата, что требует дальнейшего изучения. Рекомендуется соблюдать осторожность при проведении имплантопластики на имплантатах небольшого диаметра, которые могут стать более склонными к перелому.
С клинической точки зрения, необходимо учитывать увеличивающиеся риски формирования послеоперационных рецессий мягких тканей в средне-щечной области имплантата после имплантопластики, по сравнению с реконструктивными подходами, особенно в случаях, когда эстетика может быть нарушена.
Показания и эффективность реконструктивных подходов
После удаления грануляционной ткани и деконтаминации поверхности имплантата, желательно провести хирургическую реконструкцию, так как она позволяет восстановить анатомию утраченных тканей, достичь реостеоинтеграции и ограничить риски рецессии мягких тканей около имплантата. В систематических обзорах сообщают о результатах таких реконструктивных методик с неоднозначными результатами. Широкий разброс результатов может быть обусловлен неоднородностью исследований в отношении тяжести заболевания, а также различиями в применяемых хирургических методиках.
Отдельная группа на 15-ом Европейском пародонтологогическом конгрессе занималась вопросами костной регенерации и отдельное внимание было уделено анализу факторов, связанных с пациентом, с местом проведения операции, которые клиницисты должны учитывать при рассмотрении реконструктивных методик при хирургическом лечении периимплантита.
В рамках процесса детального планирования реконструктивных оперативных вмешательств при лечении периимплантита, клиницисты должны стремиться к соблюдению следующих условий, связанных с пациентом:
- пациент готов к вмешательству и эффективному участию в индивидуальной программе поддерживающей терапии;
- пациент имеет реалистичные ожидания;
- имеется низкий уровень зубного налета во всей полости рта (менее 20%);
- имеется низкий уровень кровоточивости во всей полости рта (менее 20%);
- курение менее 10 сигарет/день;
- отсутствие медицинских противопоказаний к хирургическому/ реконструктивному вмешательству.
В дополнение к этим факторам, связанным с пациентом, врачи также должны оценить следующие факторы, связанные с местом проведения операции:
- глубина внутрикостного дефекта >3мм;
- конфигурация дефекта: в идеале — изолированный трех- или четырехстенный дефект;
- наличие выраженной кератинизированной слизистой оболочки.
После изучения последних литературных данных, становится ясно, что подавляющее большинство исследований не учитывает все эти факторы, и это создает путаницу среди клиницистов относительно того, когда и где следует применять реконструктивный подход.
Основной целью XVIII Европейского конгресса по пародонтологии было обобщить научно обоснованные рекомендации по отдельным вмешательствам, используемым при лечении периимплантных патологий. Эти рекомендации основаны на имеющихся научных данных и/ или на консенсусном заключении экспертов. Для формирования рекомендаций по эффективности костной реконструктивной терапии в лечении периимплантных дефектов, был использован систематический обзор Donos с соавторами. На основании проведенного метаанализа был сделан вывод о том, что «как лоскутные операции, так и реконструктивных методики могут значительно улучшить клинические параметры периимплантной области в течение 12 месяцев наблюдения, при этом реконструктивные операции приводят к улучшению рентгенографических результатов». Таким образом, поскольку реконструктивная хирургия не дает значительных улучшений клинических параметров по сравнению по сравнению с лоскутными операциями, клиницисты чаще будут склоны рассматривать менее сложный подход (т.е. лоскутную операцию). Однако следует учитывать, что на семинаре рассматривались различные методы реконструктивных операций: использование эмалевых протеинов, различные костные графты с 10% коллагеном или без него, как с коллагеновой мембраной, так и без нее; титановые гранулы; графты с бета-трикальцийфосфатом с доксициклином пролонгированного действия. Метаанализ мог быть проведен только для оценки изменения глубины зондирования между исходным уровнем и через 12 месяцев для 4 исследований, в которых использовались костный трансплантат в сочетании с мембраной или без нее, в то время как исследования с использованием титановых гранул или других биоактивных факторов не были включены.
Кроме того, не удалось установить иерархию эффективности между различными биоматериалами, используемыми для реконструктивной хирургии. Это не означает, что используемые в настоящее время трансплантаты неэффективны. В частности, депротеинизированный костный графт животного происхождения с 10 % коллагеном получил множество положительных отзывов в последние годы от ряда авторов. Кроме того, в некоторых исследованиях сообщалось, что использование барьерной мембраны может повысить риск ранних осложнений, в первую очередь дегисценции мягких тканей и обнажения мембраны и трансплантата.
В задачи обзора не входило дать указания относительно влияния дизайна лоскута и хирургического вмешательства на исход лечения. Тем не менее, эти характеристики могут играть решающую роль при принятии решения о хирургическом реконструктивном подходе. В действительности, необходимо подтвердить, что реконструктивное лечение периимплантных дефектов это больше, чем простое добавление графта по средствам формирования лоскута, как это часто бывает в ходе рандомизированных контролируемых испытаний.
Учитывая эти недостатки, в настоящее время не существует убедительного доказательного подхода для реконструктивной хирургии периимплантных дефектов. Клиническое ведение таких случаев как правило, основано на «экспертном мнении» и взято из опыта регенеративного лечения дефектов пародонта. Основная цель таких хирургических методик – это ограничить послеоперационную рецессии мягких тканей.
Для регенеративного лечения пародонтальных дефектов было разработано несколько хирургических техник как для оптимизации первичного закрытия дефекта, так и для минимизации хирургической травмы внутрикостных дефектов. Основной принцип заключается в формировании одного лоскута (т.е. только на щечной или только на нёбной/ язычной поверхности, в зависимости от того, в каком направлении располагается дефект) для доступа к дефекту, оставляя по крайней мере один межпроксимальный сосочек интактным.
Другим важным аспектом является формирование раннего и длительного эффективного барьера вокруг шейки имплантата, предназначенного для биологической защиты периимплантных структур.
В отсутствие четких и научно обоснованных хирургических рекомендаций, следует придерживаться некоторых общих концепций для реконструктивного лечения периимплантных дефектов:
- глубокие и узкие дефекты являются более благоприятными для стабилизации трансплантата и последующего формирования новой кости;
- расширение полнослойного лоскута должно быть тщательно спланировано, сбалансировано относительно целей, принципа минимальной инвазивности и необходимостью иметь доступ к дну дефекта;
- регенеративный биоматериал должен быть выбран на основе соответствующих рекомендаций и применяться без переполнения дефекта;
- графт следует вводить только после полного удаления грануляционной ткани и декотаминации поверхности имплантата;
- в случае недостаточной ширины кератинизированной слизистой оболочки, соединительнотканный трансплантат должен быть адаптирован по всему дефекту таким образом, чтобы покрыть 2-3мм окружающей альвеолярной кости. Это обеспечивает стабильность костного графта. Если дефект имеет циркулярную форму без кератинизированной слизистой оболочки, большой соединительнотканный трансплантат может быть вырезан с помощью круглого лезвия и адаптирован по окружности вокруг дефекта;
- пациенты должны быть четко проинструктированы о том, как защищать, ухаживать и проводить гигиену в области вмешательства, чтобы способствовать первичному заживлению хирургической раны.
Случай, представленный на фото ниже, хорошо иллюстрирует типичное успешное лечения тяжелого периимплантного дефекта. Учитывая изложенные концепции, можно утверждать, что внутрикостные периимплантные дефекты в области правильно установленных имплантатов, могут быть успешно вылечены с помощью реконструктивной хирургии или без нее в большом проценте случаев.
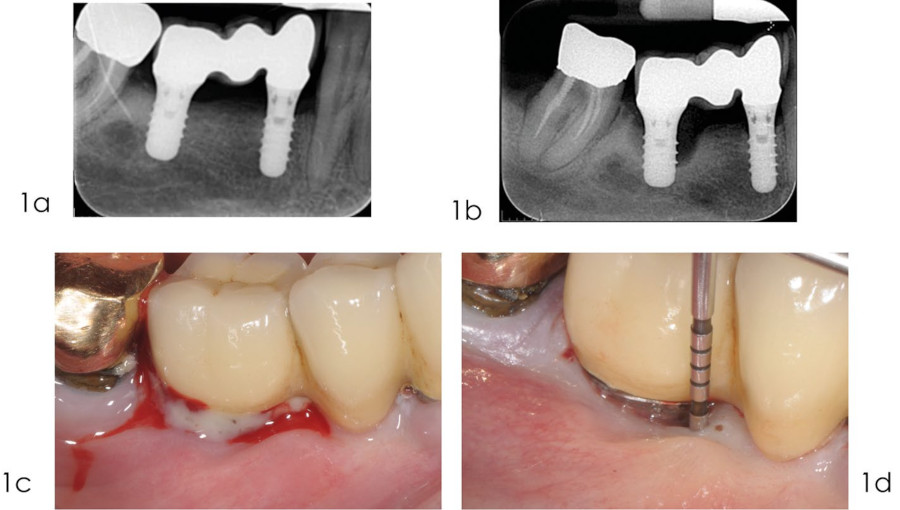
Фото 1. Реконструктивное лечение периимплантита: диагностический этап
а) рентгенограмма, сделанная в сентябре 2010 года через 3 года после установки протеза, показывает оптимальный уровень костной ткани вокруг имплантата;
b) на рентгенограмме, сделанной в декабре 2014 г., отмечается выраженная потеря костной ткани в области имплантата 4.6;
c) кровотечение при легком зондировании и/или нагноение являются основными клиническими признаками мукозита и периимплантита;
d) при обследовании тканей, окружающих имплантат, наблюдаются клинические признаки воспаления, увеличенная глубина зондирования, а также рентгенологическая потеря костной массы по сравнению с предыдущими обследованиями. Присутствуют признаки того, что развитие периимплантита может быть связано с отсутствием кератинизированной слизистой оболочки.
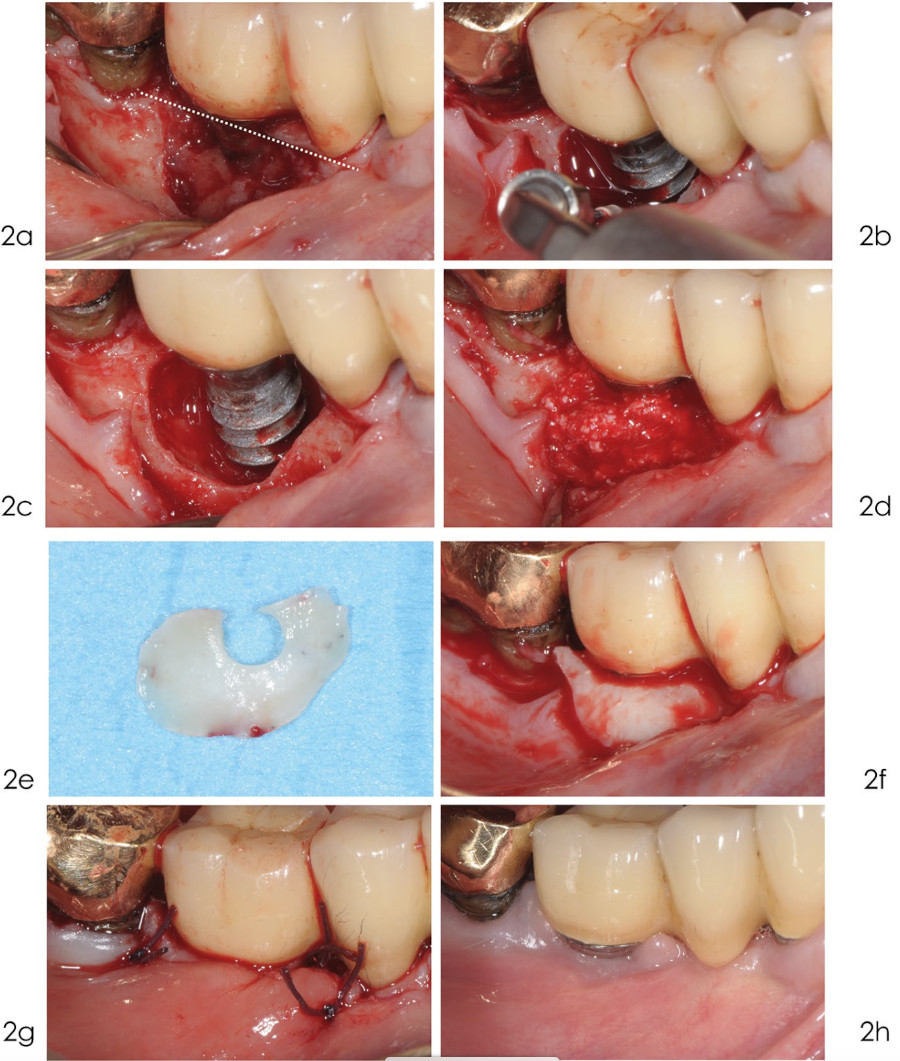
Фото 2. Реконструктивное лечение
а) был выполнен линейный крестообразный разрез, оставляющий медиальный сосочек на месте, чтобы облегчить последующую фиксацию лоскута поверх дефекта;
b) открытая поверхность имплантата была тщательно очищена с помощью ультразвука с использованием насадки с тефлоновым покрытием и непрерывным орошением физиологическим раствором;
c) после удаления грануляционной ткани поверхность имплантата обработана 24% раствором ЭДТА и 1% гелем с хлоргексидином;
d) депротеинизированный графт из бычьей кости с содержанием 10% коллагена внесен в дефект;
e) соединительнотканный трансплантат U‑образной формы забран с бугра верхней челюсти;
е) соединительнотканный трансплантат укладывается вокруг шейки имплантата, перекрывая весь дефект, чтобы обеспечить стабильность графта;
g) наложение швов из викрила 4/0 обеспечивает оптимальное заживление;
h) заживление в течение 1 года. Признаков воспаления нет. Вокруг имплантата теперь видна полоска кератинизированных ткани.
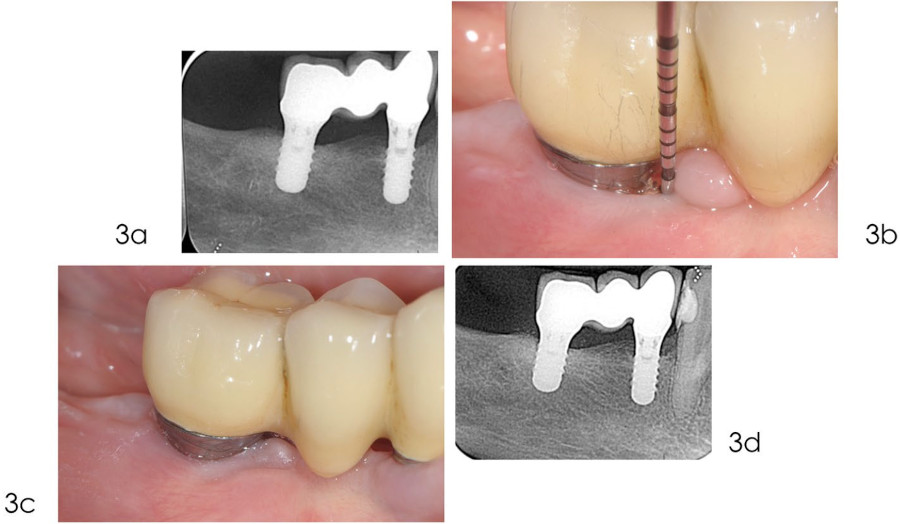
Фото 3. Последующее наблюдение (поддерживающий уход)
а) рентгенограмма, сделанная в мае 2019 года, показывает полное заполнение дефекта костью;
b) после хирургического лечения пациенту было рекомендовано следовать индивидуальной программе поддерживающей терапии, включающей соответствующие манипуляции по гигиене полости рта, удалению биопленки и мониторингу показателей риска;
c) клиническая картина в ноябре 2021 года демонстрирует здоровые ткани вокруг имплантата. При зондировании обнаруживается неглубокий карман и отсутствие кровотечения;
d) рентгенограмма, сделанная в марте 2023 года, через 16 лет после установки имплантата, показывает оптимальный уровень кости.
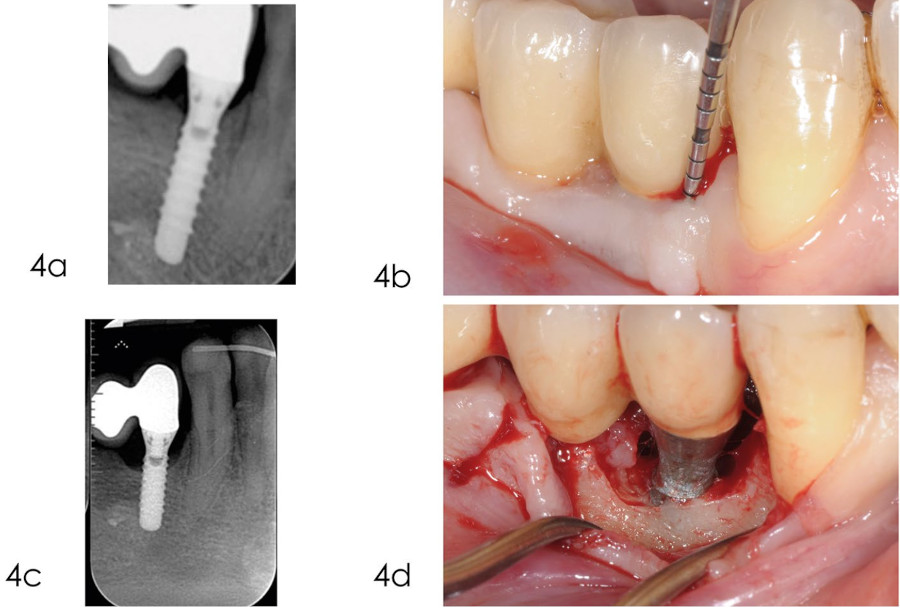
Фото 4. Хирургическое лечение периимплантита с помощью открытой обработки
а) рентгенограмма, сделанная через год после установки протеза, показывает оптимальный уровень костной ткани вокруг имплантата;
b) кровотечение при осторожном зондировании и глубине кармана 6 мм через 5 лет после установки имплантата;
c) на рентгенограмме, сделанной в декабре 2014 г., показана незначительная потеря костной массы в области имплантата 4.4;
d) отслаивание полнослойного лоскута с получением доступа к костному дефекту до уровня 2 витка имплантата.
По причине наличия тонкого костного гребня без внутрикостного компонента реконструктивный подход не был выбран, предпочтение было отдано открытой обработке.
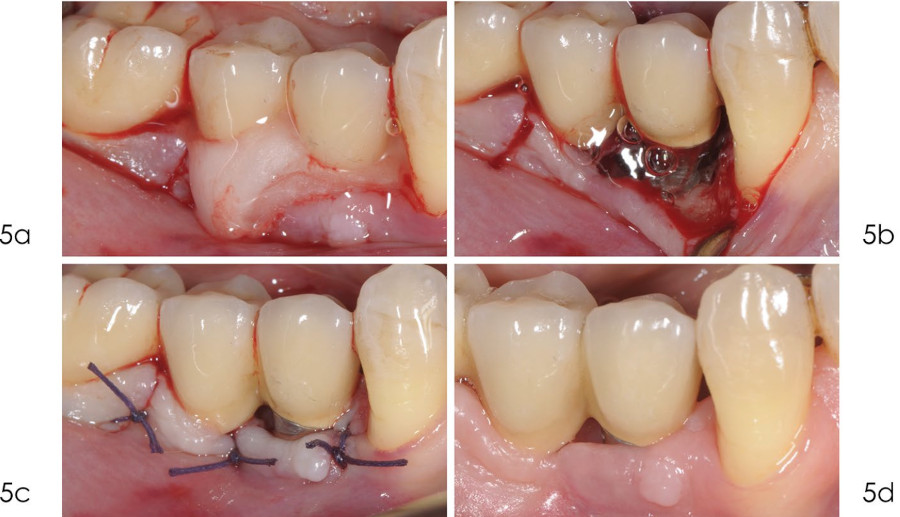
Фото 5.
а) после удаления грануляционной ткани поверхность имплантата была обработана с помощью 24% раствора ЭДТА в течение 2 минут;
b) после орошения физиологическим раствором на 2 минуты нанесли 1% раствор хлоргексидина;
с) лоскут зафиксирован швами из викрилом 4/0, что обеспечивает оптимальное заживление;
d) заживление протекает без осложнений.
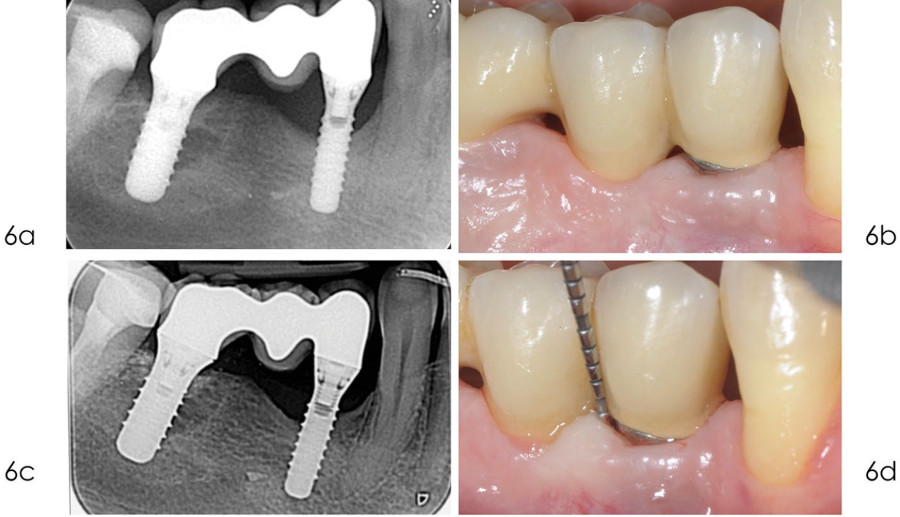
Фото 6.
а) рентгенограмма, сделанная в сентябре 2020 года, через 10 лет после установки имплантата, показывает стабильный костный дефект;
b) клиническая картина в сентябре 2020 года показывает, что мягкие ткани вокруг имплантата без признаков воспаления;
c) рентгенограмма, сделанная в январе 2024 года, подтверждает отсутствие дополнительной потери костной массы в дистальном отделе и минимальное улучшение в медиальной части;
d) клиническая картина в январе 2024 года, спустя 14 лет после установки имплантата. Наблюдается минимальная рецессия мягких тканей. Зондирование показывает стабильную, хотя и не идеальную глубину зондирования в этой области.
Заключение
Основной целью лечения периимплантита является устранение инфекции и предотвращение прогрессирования потери костной ткани.
В отличие от пародонтита, нехирургическое лечение обычно недостаточно для лечения периимплантита, особенно в запущенных случаях с глубокими костными дефектами. Тем не менее, нехирургическое лечение обычно является первым этапом, поскольку оно создает лучшие условия для тканей, окружающих имплантат, перед тем как проводится хирургическое лечение периимплантита.
Независимо от выбранного подхода к хирургическому лечению, адекватный контроль гигиены является основополагающим фактором для достижения успеха лечения. Вмешательства, где подразумевается формирование лоскута только для открытой обработки, могут быть связаны с послеоперационными рецессиями слизистой оболочки и последующими дегисценциями мягких тканей, что может негативно влиять на эстетику.
Реконструктивные методы лечения направлены на воссоздание твердых и мягких тканей, чтобы облегчить долгосрочный уход и сохранить эстетику.
Реконструктивное хирургическое лечение периимплантита подразумевает формирование лоскутов с особым дизайном, чтобы минимизировать хирургическую травму, сохранить интерпроксимальные ткани и поддержать уровень слизистой оболочки в области имплантата.
Дизайн лоскута может играть ключевую роль в улучшении результатов реконструктивного лечения периимплантных дефектов и должен определяться конфигурацией дефекта (форма, количество стенок, глубина), тяжестью дефекта, типом имплантата, его положением и состоянием мягких тканей около имплантата. Все эти факторы делают рандомизированные контролируемые исследования довольно сложными в проведении. Исходя из всего вышесказанного, следует ориентироваться на использование минимально инвазивного подхода, чтобы минимизировать травмы тканей, но при этом помнить о необходимости обеспечить адекватный доступа ко всему костному дефекту.
По материалам «Surgical treatment of peri-implantitis» Mario Roccuzzo, Davide Mirra, Andrea Roccuzzo, 2024
