Структура и функции пародонта определяется интеграцией четырех основных тканей: периодонтальная связка (PDL), цемент корень зуба, альвеолярная кость и десна.
В совокупности они обеспечивают биологический и физический барьер для множества факторов, которые действуют на зубы в результате жевательной нагрузки и сложной микробной среды полости рта. Целостность этой системы чаще всего бывает нарушена из-за хронического воспаления, вызванного сложными бактериальными сообществами. Тем не менее, пародонт представляет собой адаптационно гибкий орган, который может быть описан как динамическая структура, которая является чувствительной к множеству факторов. Ему присуща способность переводить механические стимулы в биохимические сигналы которые управляют его гомеостазом (Burger et al. 1995; Duncan & Turner 1995; Маротти 2000; Marotti & Palumbo 2007; Bonewald & Johnson 2008). Его структура и функции во время ремоделирования и лечения определяется сочетанным действием важных биологически активных белков. К ним относят фактор роста, полученных из тромбоцитов (PDGF), сосудистый эндотелиальный фактор роста (VEGF), эпидермальный фактор роста(EGF), фактор роста фибробластов (FGF), костные морфогенетические белки (BMPs), инсулиноподобный фактор роста -1 (IGF1), трансформирующий фактор роста бета 1 (TGF1) в результате чего формируется высокий адаптивный потенциал, который защищает и поддерживает целостность его четырех основных компонентов.
У людей патологические изменения, которым подвергается удерживающий аппарат зуба, являются прежде всего следствием воспалительных заболеваний пародонта, которые подрывают и нарушают функциональную и структурную целостность альвеолярного отростка, периодонтальной связки и цемента.
Восстановление первоначальной структуры, свойств и функций этих тканей является идеальным и желаемым результатом пародонтальной терапии. К несчастью, нарушение процесса заживления часто препятствует нормальному восстановлению пародонта. В результате могут быть получены разные клинически приемлемые исходы.
Заживление раны: результаты и основные понятия
Прежде чем исследовать каскад клеточных и молекулярных событий заживления ран, важно, отметить, что конкретные модели заживления, которые были исследованы в пародонтальном комплексе являются более предпочтительными.
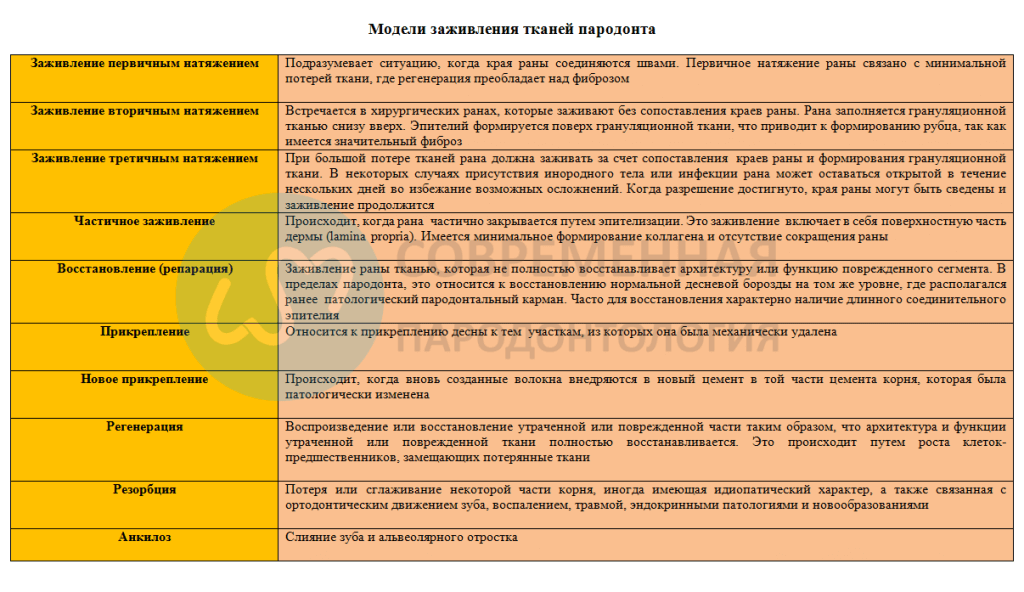
С основной гистологической точки зрения, типы регенерации, которые могут быть достигнуты в пародонте, описаны в таблице ниже.
Биология заживления ран
Процесс заживления ран является основным механизмом организма для восстановления целостности тканей при травме. Если заживление раны не происходит должным образом, хроническое нарушение защитного барьера может привести к тяжелым физиологическим, иммунологическим и метаболическим нарушениям. Заживление ран в основном представляет собой динамический процесс, который включает в себя несколько типов клеток и биологических медиаторов. В пределах активной системы пародонтальной раны, клеточные популяции мигрируют, дифференцируются и пролиферируют; эпителиальные и соединительные ткани взаимодействуют; а также огромное количество молекул цитокинов и внеклеточного матрикса (ECM) организуют весь этот процесс, который состоит из перетекающих друг в друга фаз.
Фазы заживления ран
Общие принципы лечения, клеточные и молекулярные события, наблюдаемые в организме, также применимы к процессам заживления, которые имеют место после операции на пародонте. Травматическое воздействие вызывает повреждение капилляров и кровоизлияние, в результате чего образуется сгусток крови. Формирование сгустка- это немедленный ответ на любую травму. Сгусток имеет две функции: он временно защищает оголенные ткани, и это служит временной матрицей для миграции клеток. Сгусток крови состоит из всех клеточных компонентов крови (включая красные и белые клетки крови и тромбоциты) в матрице из фибрина, фибронектина плазмы, витронектин и тромбоспорин.
Помимо этого, процесс был разделен на три этапа:
1. Фаза воспаления
2. Фаза грануляции
3. Фаза формирования и ремоделирования матрицы (созревания) (Wikesjo et al. 1992).
Каждый из этапов заживления раны имеет важное значение для успешного заживления, но первичный процесс часто определяет результат
Воспалительная фаза
Факторы роста, присутствующие в сгустке, направляют воспалительные клетки, а затем служат для регулирования процесса грануляции. В течение нескольких часов после травмы воспалительные клетки(преимущественно нейтрофилы и моноциты) заселяют сгусток. Эти клетки очищают рану от бактерий и некротических тканей путем фагоцитоза и высвобождения ферментов и кислородных радикалов. В течение 3 дней воспалительная реакция переходит в свою последнюю фазу.
Макрофаги мигрируют в область раны, они способствуют процессу очищения путем фагоцитоза отработавших полиморфноядерных лейкоцитов и эритроцитов. Кроме того, макрофаги высвобождают большое количество биологически активных молекул, таких как воспалительные цитокины и факторы роста, которые регулируют другие воспалительные клетки, а также фибробластические и эндотелиальные клетки, играя, таким образом, важную роль при переходе раны из воспалительной фазы в фазу формирования грануляционной ткани.
Фаза грануляции
Популяция нейтрофилов сменяется макрофагами в течение нескольких дней. Макрофаги также служат для очищения раны. Они играют важную роль в формировании грануляционной ткани. Формирование грануляционной ткани начинается примерно на 4 день. Макрофаги высвобождают факторы роста, способствующие заживлению. Факторы роста и цитокины, секретируемые макрофагами участвуют в распространении и миграция фибробластов, эндотелиальных клеток и гладких мышечных клеток в область раны. Клетки в ране размножается по радиусу, создавая кластеры межклеточных соединений и соединений клеток с клеточным матриксом. Макрофаги и фибробласты продолжают экспрессировать факторы роста, которые регулируют заживление, как в экзокринно так и аутокринно.
Исследования показали, что раневые участки обогащенные факторами роста имеют большую скорость образования грануляционной ткани (Sporn et al. 1983). На 7 день после начала заживления раны грануляция преобладает над участком раны и происходит формирование коллагеновых волокон. В конце концов, клетки и матрица образуют между собой связи, которые генерируют согласованное напряжение, приводящее к сокращению тканей.
Фаза формирования грануляционной ткани постепенно переходит в заключительную фазу репарации, в которой восстановленная, более богатая клетками ткань подвергается созреванию и последовательному ремоделированию для удовлетворения функциональных потребностей.
Фаза созревания
Фибробласты, ответственные за замену временного экстрацеллюлярного матрикса, производят новый богатый коллагеном матрикс.
Примерно через 1 неделю синтезируется новый коллагеновый матрикс, при этом некоторые фибробласты трансформируются в миофибробласты и экспрессируют альфа-миоактин. Это преобразование отвечает за сокращение раны. Эндотелиальные клетки, ответственные за ангиогенез, мигрируют в молодую матрицу раны, чтобы сформировать сосудистые трубки и петли, а по мере созревания матрицы, эндотелиальные клетки подвергаются запрограммированной гибели клеток (апоптоз) и количество сосудистых единиц снижается. Созревание грануляционной ткани приводит к регенерации или восстановлению (образованию рубцов) поврежденных тканей. Будут ли поврежденные ткани восстанавливаться с формированием рубца или регенерировать зависит от двух важных факторов: наличия необходимого типа клеток и наличие или отсутствие сигналов, необходимых для направления и стимулирования этих клеток.
Факторы, влияющие на заживление
Важно помнить, что в пародонте, как и в других областях тела восстановительный потенциал зависит от местных и системных факторов.
Местные факторы
Заживление после пародонтальной хирургии может быть отсроченным и измененным многочисленными местными факторами.
Некоторые из этих факторов включают в себя:
• Зубной налет (биопленка)
• Чрезмерные манипуляции тканями во время лечения
• Травма тканей
• Наличие инородных тел
• Повторные процедуры лечения, которые нарушают упорядоченную клеточную активность в процессе заживления
• Нежелательная сосудистая перфузия в окружающей области
Процесс восстановления улучшается с помощью санации (удаление дегенерированной и некротической ткани), иммобилизация области заживления и давления на рану. Потребление клетками кислорода увеличивается во время заживления, тем не менее, оно не наступает быстрей при искусственном обогащении тканей кислородом требования (Glickman et al. 1950).
Системные факторы
Сообщается, что однозначно регенерирующая способность уменьшается с возрастом (Holm‐Pedersen & Löe 1971). Восстановление также страдает от недостаточного питания; системных заболеваний, которые снижают использование питательных веществ организмом; а также дефицита витамина С (Barr 1965), белков (Stahl 1962) и других микронутриентов.
Гормоны также оказывают влияние на заживление. Системное введение глюкокортикоидов, таких как кортизон, препятствует восстановлению, подавляя воспалительные процессы/ реакции путем ингибирования роста фибробластов, производства коллагена и образования эндотелиальных клеток. Системный стресс, тиреоидэктомия, тестостерон, адренокортикотропный гормон и большие дозы эстрогена подавляют образование грануляционной ткани и нарушают заживление. Прогестерон при этом увеличивает и ускоряет васкуляризацию незрелой грануляционной ткани (Lindhe &Branemark 1968) и, по-видимому, увеличивает восприимчивость десневой ткани к механическим повреждениям, вызывая расширение краевых сосудов.
Заживление тканей пародонта
Для того чтобы функциональное заживление тканей пародонта произошло необходимо последовательное включение всех тех же элементов, что необходимы при его естественном развитии (Chen et al. 2011).
Хотя каскад клеточных и молекулярных событий до сих пор не ясен, очевидно, что клетки должны сначала мигрировать и прикрепиться к открытой корневой поверхности. Используя модель дефекта на крысах, создается микроокружение, которое благоприятствует пролиферации, миграция и созреванию мезенхимальных клеток -предшественников в область дефекта периодонтальной связки или в область костной ткани(Lekic et al. 1996a, b).
Этот процесс опосредуется и координируется растворимыми факторами, другими клетками и экстрацеллюлярной матрицей. Процесс раннего заживления следует классической последовательности, которая инициируется свертыванием крови и миграцией нейтрофилов и моноцитов в рану, далее следует санация и резорбция кости. Формирование кости обычно начинается с костных краев(Rajshankar et al. 1998).Через несколько дней после операцииможет наблюдаться тонкий слой цемента с соединительной тканью, особенно в апикальной области зубов, где цемент толще по сравнению с корональной областью (King et al. 1997).
Как только минерализованные ткани созданы, волокна связки приобретают ориентацию, направленность и интеграция в оба конца: в цемент и альвеолярную кость под воздействием соответствующей механической нагрузки (Mine et al. 2005; Rios et al.2011). Поэтому крайне важно, чтобы исследователи выбирали соответствующий момент времени в соответствии со сроками, в которые происходят эти события. Это необходимо для определения «окна» терапевтической эффективности проводимых манипуляций с пародонтом и введения биологически активных молекул .
Заживление пародонта, безусловно, считается более сложным процессом по сравнению с эпидермальным заживлением раны. Пародонт включает в себя цемент, функционально ориентированную связку, альвеолярную кость и десну. Поверхности между этими тканями, а также трансгингивальное положение зуба представляют собой постоянную проблему во время восстановления целостности нативных структур, поскольку они стремятся создать новую связь с несосудистыми и жизненно важными твердыми тканями поверхности корня в контексте открытой системы, которая постоянно загрязнена и находится под «бактериальной нагрузкой». Поэтому неудивительно, что результат лечения, которое происходит после всех видов десневой и пародонтальной терапии может быть разным.
Основным условием успешного лечения пародонта является чистая, не содержащая биопленки, дезактивированная поверхность корня. Терапия включает в себя как хирургическое, так и нехирургические методы, которые подразумевают обработку пораженной ткани. Это создает рану в ткани пародонта, которая подвержена воспалению.
Результаты терапии зависит от регенеративных способностей организма и от механизмов, обеспечивающих эти процессы. Важно понимать, что порядок событий вовремя заживления после лечения зависит от сложного набора биологических коммуникаций в этой области.
Исследования по заживлению ран пародонта в прошлом обеспечили базовое понимание механизмов способствующих регенерации тканей пародонта. Количество значимых исследований в этой области позволило открыть клеточные и молекулярные механизмы, которые в дальнейшем стали использоваться для создания биоматериалов, которые используются в пародонтологии на сегодняшний день.
Морфология раны пародонта включает эпителий десны, десневую соединительную ткани, связку, компоненты твердой ткани, такие как альвеолярная кость и цемент, дентин и поверхность корня. Такое строение влияет как на процесс заживления в каждом компоненте ткани, так и во всем пародонте. В то время как заживление эпителия десен и их соединительной ткани заканчиваются через несколько недель, регенерация связки, корневого цемента и альвеолярного отростка обычно происходит в течение нескольких недель или месяцев.
Окончательный результат заживления ран в эпительном слое — это образование соединительнотканного эпителия вокруг зуба(Caton et al. 1980). Восстановление соединительной ткани, с другой стороны, приводит к значительному уменьшение ее объема, тем самым клинически проявляясь как рецессия десны и увеличение пародонтального кармана. Пародонтальная связка регенерирует благодаря активности цементобластов из грануляционной ткани пародонтальной связки(Karring et al. 1985). Кроме того, происходит моделирование альвеолярного отростка после стимуляции мезенхимальных клеток из соединительной ткани десны, которые трансформируются в остеопрогениторные клетки с помощью локально экспрессированного BMP( костный морфогенетический белок).
Серия классических исследований на животных продемонстрировала, что в тканях, полученых из альвеолярного отростка или из соединительных тканей десны, отсутствуют клетки, способные вызывать новое прикрепление между связкой и вновь образованным цементом(Karring et al. 1980; Nyman et al.1980). Более того, грануляционная ткань, полученная из соединительной ткани десны или альвеолярной кости приводит к резорбции корня или анкилозу при контакте с поверхностью корня. Этого следовало ожидать, поэтому, что эти осложнения часто происходят после восстановительной пародонтальной хирургии, особенно после тех процедур, которые требуют размещения костных материалов для стимуляции формирования кости. Причину резобции корня редко можно определить; однако, можно предположить, что после хирургического вмешательства эпителий мигрирует апикально вдоль поверхности корня, образуя защитный барьер на поверхности корня (Bjorn 1965; Karring et al. 1984). Выводы из этих экспериментов на животных показали, что в конечном итоге только ткань связки содержит клетки с потенциалом формирования нового прикрепления соединительной ткани (Karring et al. 1985).
Как правило, нисходящий рост эпителия вдоль поверхности корня зуба достигает уровня связки, прежде чем последняя восстановится с новым слоем цемента и волокнами соединительной ткани. Следовательно, для того, чтобы включить и стимулировать заживление цемента и связки, необходимо препятствовать созданию длинного соединительного эпителия вдоль поверхности корня до уровня связки.
Знание принципов заживление пародонта необходимо для того чтобы обеспечить базовое понимание событий, которые происходят после хирургических вмешательств. Для достижения нового прикрепления соединительной ткани, клеткам грануляционной ткани связки необходимо пространство и время для формирования нового цемента и волокон связочного аппарата.
Заживление после пародонтальной хирургии
Заживление после десневой и пародонтальной хирургии представляет собой более сложную ситуацию, особенно в случаях, где ткань пародонта накладывается на обработанную поверхность корня, лишенную прикрепления пародонта. В этом случае края раны не являются двумя противоположными краями сосудистой части десны, а включают жесткую несосудистую минерализованную поверхность зуба с одной стороны и соединительную ткань, и эпителий лоскута десны с другой.
Ранние процессы заживление в зубодесневой области были изучены с использованием дентиных блоков, имплантированных в беззубые альвеолярные отростки, погруженные под лоскуты десен, у собак (Wikesjo et al. 1991).
Образование сгустка на границе между зубом и десневым лоскутом инициируется, когда элементы крови накладываются на поверхность корня во время операции и при закрытии раны, по-видимому, случайным образом.
Адгезия белков плазмы крови представляет собой первый этап каскада реакций заживления на границе зуб-десневой лоскут (Wikesjo et al. 1991). Через несколько минут фибриновый сгусток, прикрепленый к корневой поверхности созревает. В течение нескольких часов ранняя фаза воспаления наблюдается в виде воспалительных клеток, преимущественно нейтрофилов и моноцитов, накапливающихся на поверхности корня, и в течение 3 дней поздняя фаза воспаления доминирует в картине заживления, поскольку макрофаги мигрируют в рану с последующим образованием грануляционной ткани. На 7 день прикрепление соединительной ткани может образовываться на поверхности корня, так как коллагеновые элементы, по-видимому, ориентированы в непосредственной близости от поверхность дентина. Резорбтивное ремоделирование поверхности дентина может быть очевидным в этом интервале наблюдения.
В течение 14 дней вновь образованные коллагеновые волокна приобретают ориентацию, указывающую на физическое прикрепление к дентину (Selvig et al. 1988). Рамфьорд и соавторы (1966) сообщили, что созревание коллагена тканей и функциональной ориентации соединительной ткани занимает 3-5 недель. Кроме того, отложение новой костной ткани начинает происходить с 10-21 дня (Wilderman 1964). В конце концов, образование цемента может быть начато, но не ранее, чем через 3 недели после закрытия раны (Hiatt et al. 1968). Лишь несколько экспериментальных исследований оценили функциональную целостность созревшей пародонтальной раны.
Hiatt et al. (1968) исследовали прочность на разрыв поверхности зубного лоскута после реконструктивной хирургии относительно небольших хирургических дефектов расхождения над верхнечелюстными клыками у собаки. Они обнаружили, что прочность на разрыв увеличилась с примерно 200 г через 3 дня после операции до 340 г через 5-7 дней после операции и до> 1700 г через 2 недели после операции. Другими словами, они обнаружили, что относительно ограниченная пародонтальная рана может не достичь функциональной целостности до 2 недель после операции. Эти данные предполагают, что целостность раны на ранней фазе заживления зависит, прежде всего, от стабилизации лоскутов десны, предлагаемых при наложении швов. Гистологические исследования показали, что различные хирургические процедуры могут привести к различным схемам заживления. Опытным путем было выяснено, что заживление пародонта обычно характеризовалось созреванием соединительной ткани десны, некоторой регенерацией альвеолярной кости и цемента и, что наиболее важно, эпителизацией поверхности корня (Listgarten & Rosenberg 1979). Длинный соединительный эпителий обычно находится на поверхности корня после традиционной пародонтальной хирургии и обеспечивает защиту от бактериальной инвазии и анкилоза. Однако снижение роста эпителия от края десны предотвращает корональную миграцию клеток связки, которые ответственны за образование соединительнотканного прикрепления.
Манипуляции с мягкими тканями в ранних регенеративных техниках соответствовали принципу удаления эпителия, что включало повторное выскабливание под десной во время заживления для контроля эпителизации поверхности корня. Более поздние подходы включали в себя предотвращение контакта эпителия десны с поверхностью корня в ранней фазе заживления с использованием клеточно-окклюзионной мембраны. Исследования на людях и животных сообщил об успешном применении мембраны для облегчения миграции и пролиферации клеток связки и альвеолярной кости в раневой поверхности(Nyman et al.1982; Gottlow et al. 1984).
Общие концепции заживления были применены для тканей пародонта. Было проведено несколько исследований в попытке выяснить точные механизмы, которые управляют процессом и определить окончательную модель процесса заживления.
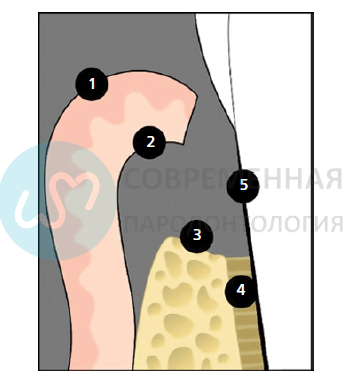
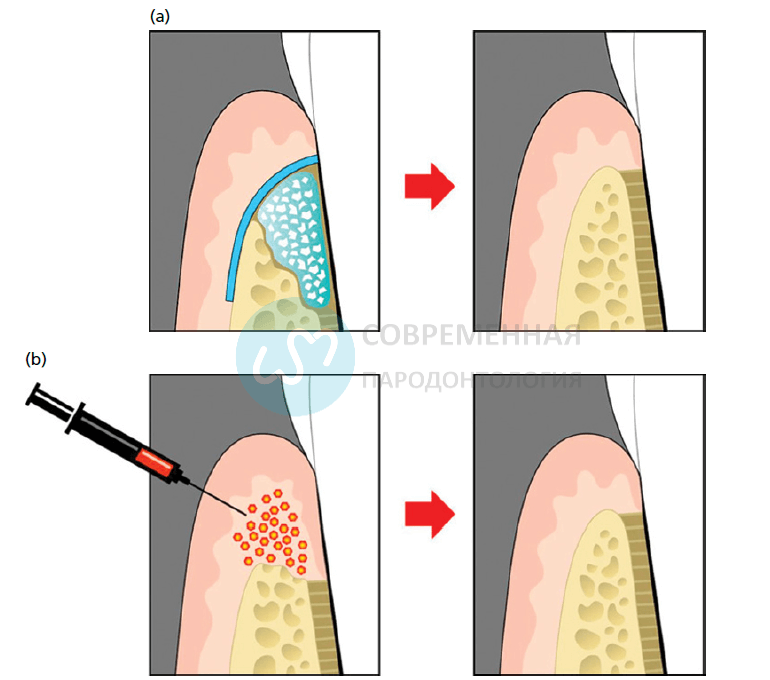
Пародонтальная рана после лоскутной операции 1-эпителий десны, 2- соединительная ткань десны, 3- кость, 4- связка, 5-цемент или дентин корня зуба
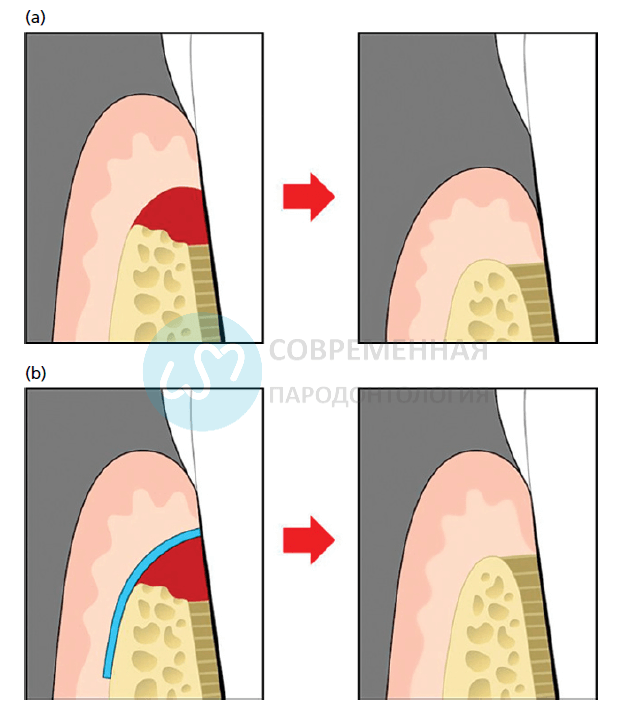
а) обычный процесс заживления после адаптации пародонтального лоскута при значительном сокращении прикрепления b) чтобы активизировать восстановление цемента и связки, эпителий десны должен быть лишен возможности создания длинного соединительного эпителия вдоль поверхности корня вниз (например, размещение биорезорбируемой мембраны)
Расширенный регенеративный подход к реконструкции тканей пародонта
Регенерацию пародонта оценивают с помощью зондирования, рентгенографического анализа, прямых измерений новой кости и гистологии (Reddy & Jeffcoat 1999). Во многих случаях, которые считаются клинически успешными, в том числе случаи со значительным приростом альвеолярной кости, гистологически все же может наблюдаться эпителиальная выстилка вдоль обработанной поверхности корня вместо вновь образованных волокон связки и цемента (Listgarten & Rosenberg 1979).
В целом, однако, клинические результаты методов регенерации пародонта, как было показано, зависят от (1) связанных с пациентом факторов, таких как борьба с бляшкой, прекращение курения, остаточная пародонтальная инфекция или воздействие на мембраны в процедурах управляемой регенерации тканей (ОТО); (2) влияние окклюзионных сил, которые дают прерывистые нагрузки в осевом и поперечном направлениях; а также (3) факторы, связанные с клиническими навыками оператора, такие как недостаточность первичного закрытия хирургической раны (McCulloch 1993).
Хотя было показано, что модифицированные конструкции лоскутов и микрохирургические подходы положительно влияют на результаты регенерации мягких и твердых тканей, во многих случаях клинический успех регенерации пародонта остается ограниченным. Кроме того, хирургические протоколы для регенеративных процедур требуют навыков и, следовательно, могут быть недоступны для ряда врачей. Следовательно, как клинические, так и доклинические исследования продолжают оценивать прогрессивные регенеративные подходы (Ramseier et al. 2012) с использованием новых мембранных техник (Jung et al. 2006), белков факторов роста, стимулирующих синтез белка (Giannobile 1996; Dereka et al. 2006; Kaigler et al. 2006) или приложения для доставки генов (Ramseier et al. 2006), соответственно, чтобы упростить и улучшить восстановление отсутствующей пародонтальных тканей.
Регенеративная хирургия
Регенеративная терапия пародонта включает в себя методы, которые специально предназначены для восстановления утраченных структур, поддерживающих зуб, включая цемент, связку и кость. Наиболее распространенные пародонтальные показания для этих процедур включают глубокие внутрикостные дефекты, дефекты фуркации верхних премоляров и моляров и локализованные дефекты в виде рецессии десны. Клинический успех регенерации пародонта все еще остается ограниченным во многих случаях. Следовательно, как клинические, так и доклинические исследования продолжает совершенствовать область пародонтальной регенеративной терапии, оценивая инновационные подходы к тканевой инженерии, которые включают оптимизированную технологию изготовления каркасов, новые технологии барьерных мембран (Jung et al. 2006), белки, стимулирующие рост клеток (Giannobile 1996; Dereka et al. 2006; Kaigler et al. 2006), а также приложения для доставки клеток и генов (Ramseier et al. 2006)
Направленная тканевая регенерация
Гистологические данные о регенерации пародонта в исследованиях и концепции «компартментализации» Мельхера показали, что новое соединение может быть получено, если клетки из связки прикрепляются на поверхности корня во время заживления (Melcher 1976). Следовательно, клиническое применение НТР в пародонтологии включает в себя установление физического барьера-мембраны, чтобы позволить поражённой пародонтитом поверхности быть заселенной клетками в первую очередь из связки, собственной пластинки эпителия десны, цементными клетками и альвеолярной кости. Методы НТР используют барьерные мембраны для того, чтобы облегчить миграцию костных клеток и клеток связки к дефектам, предотвращая проникновение в мягкие ткани. Эти знания были ключом к разработке стандартных клинических процедур для размещения мембран. НТР недавно был объединен с доставкой различных факторов, которые необходимы, чтобы увеличить регенеративный ответ.
Клиническое применение факторов роста в регенерации пародонта
Ряд исследований был сфокусирован на модификации вовлеченной в пародонтит поверхности корня с целью ускорения формирования новой соединительной ткани. Однако, несмотря на гистологическое подтверждение регенерации после биомодификации поверхности корня лимонной кислотой, результаты контролируемого испытания не показали каких-либо улучшений в клинических условия по сравнению с необработанными кислотой образцами (Fuentes et al. 1993; Mariotti 2003). Ранее биомодификация поверхности корня с помощью ЭДТА и последующей обработкой эмалево-матричными протеинами была применена для стимуляции регенерации. Применение матричных белков эмали (амелогенины) также оценивали как стимулятор регенерации, так как он инициирует события, которые происходят во время роста тканей пародонта (Gestrelius et al. 2000). Коммерчески доступный продукт Emdogain®, очищенный кислотный экстракт свиного происхождения, содержит производное эмалевого матрикса (EMD), которое продемонстрировало способность ускорять регенерацию пародонта (Sculean et al. 2007). До сих пор, EMD отдельно или в сочетании с трансплантатами продемонстрировал свой потенциал для эффективного лечения внутрикостных дефектов и клинические результаты кажутся стабильными в течение длительного времени (Trombelli & Farina 2008).
Тромбоцитарный фактор роста (PDGF) является членом семейства многофункциональных полипептидов и оказывает свои биологические эффекты на пролиферацию клеток, миграцию, синтез и антиапоптоз (Heldin et al. 1989; Rosenkranz & Kazlauskas 1999). Клиническое применение PDGF было успешно и показало восстановление альвеолярного отростка и повышение уровня клинического прикрепления. Начальные клинические испытания показали успешное восстановление фуркаций класса II с использованием деминерализованного лиофилизированного костного аллотрансплантата (DFDBA), насыщенного rhPDGF-BB (Nevins et al. 2003). Впоследствии было показано, что hPDGF-BB, смешанный с синтетической матрицей бета-трикальцийфосфата ускоряет восстановление глубоких внутрикостных карманов, измеренных по рентгенографически, в большом многоцентровом рандомизированном контролируемом исследовании (Nevins et al. 2005, 2013). И то и другое исследования также показали, что использование rhPDGF-BB было безопасным и эффективным при лечении костных дефектов пародонта.
Костные морфогенетические белки (BMP) представляют собой многофункциональные полипептиды, которые обладают мощной способностью к регенерации костей. Fiorellini et al. (2005) сообщили, что в моделях дефекта щечной стенки образование кости после удаления зуба было значительным, когда дефект обрабатывали рекомбинантным человеческим BMP-2 (rhBMP-2), доставляемым биоабсорбируемой коллагеновой губкой, по сравнению с обработкой только коллагеновой губкой . Кроме того, BMP-7, также известный как остеогенный белок 1 (OP-1), стимулирует регенерацию кости вокруг зубов, эндоссальных зубных имплантатов и в процедурах синуслифтинга.
В целом, локализованная доставка факторов роста в раны пародонта показала многообещающие результаты, но пока недостаточные для стимулирования предсказуемой инженерии тканей пародонта (Kaigler et al.2006).
Факторы роста после доставки к определенному участку, как правило, страдают от нестабильности и быстрого растворения, предположительно из-за протеолитического распада, рецептор-опосредованного эндоцитоза и растворимости как способа доставки. Поскольку их период полураспада значительно сокращен, период воздействия может быть не достаточным для воздействия на остеобласты, цементобласты или клетки связки.
Недавнее клиническое исследование оценило регенераторные эффекты системной доставки терипаратида, рекомбинантной формы паратиреоидного гормона (ПТГ). Исследование продемонстрировало анаболический эффект пародонта в пользу регенерации. После операции на пародонте терипаратид системно доставлялся в течение 6 недель, результаты сравнивались с плацебо. Доставка этой рекомбинантной молекулы была связана с улучшением клинических результатов, включая ускоренное разрешение дефектов альвеолярной кости и ускоренное заживление костной раны (Bashutski et al. 2010).
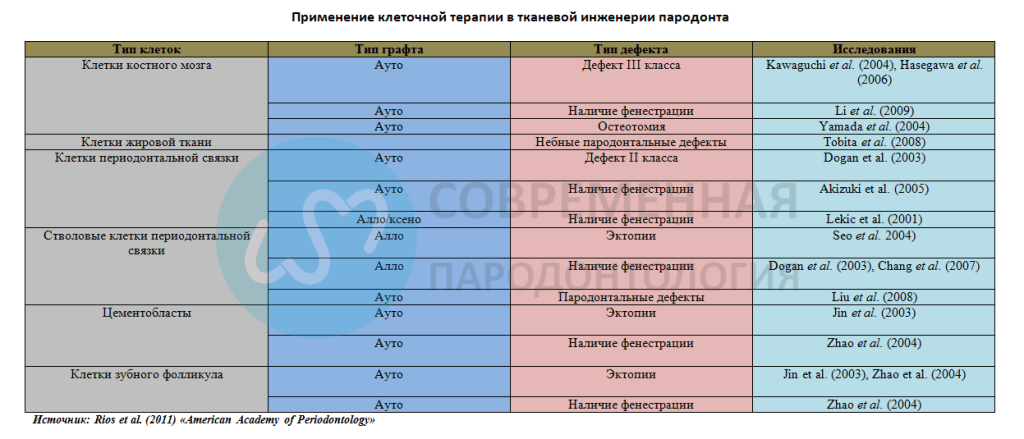
Клеточная терапия для регенерации пародонта
Еще один подход для управления дефектами мягких и твердых тканей включает клеточную терапию. Для регенерации межзубных сосочков ранние исследования клеточной терапии с использованием культивируемых фибробластов показали успех в лечении межзубной папиллярной недостаточности (McGuire & Scheyer 2007).
Для более крупных дефектов мягких тканей, например слизистой оболочки полости рта человека, используется препарат, созданный из аутогенных кератиноцитов (EVPOME), помещенных на трупный дермальный носитель (Alloderm®). Он показал эффективность в заживлении ран по сравнению с применением только дермального носителя (Izumi et al. 2003). EVPOME также успешно применяется для лечения пациентов, страдающих плоскоклеточной карциномой языка, лейкоплакией языка, десны и слизистой оболочкой щеки или гипоплазией альвеолярного отростка (Hotta et al. 2007)). В других случаях аллогенные дермальные фибробласты используются для ускорения образования кератинизированной ткани при дефектах слизистой оболочки десны(McGuire & Nunn 2005).
Сконструированная на тканевой основе живая клеточная конструкция, состоящая из жизнеспособных неонатальных кератиноцитов и фибробластов, была оценена на ее способность увеличивать кератинизированную десну вокруг зубов и дала клинические результаты, сходные с обычными аутотрансплантатами десны (McGuire et al. 2011).
Эта клеточная конструкция также обладает сильным потенциалом стимулировать экспрессию ангиогенных факторов по сравнению с аутогенными свободными десневыми трансплантатами.
Генная терапия для восстановление тканей пародонта
Хотя обнадеживающие результаты для регенерации пародонта были зарегистрированы в различных клинических исследования с использованием рекомбинантных факторов роста, локальной доставкой белка на носителе, тем не менее эти способы имеют ограничения, такие как преходящая биологическая активность, инактивация протеазами крови и низкой биодоступностью. Поэтому новые подходы направлены на разработку методов, которые оптимизируют целенаправленность действия факторов роста, чтобы максимизировать терапевтический результат регенеративных процедур.
Генетические подходы в инженерии тканей пародонта показывают ранний прогресс в достижении доставки генов факторов роста, таких как PDGF или BMP, к поражениям пародонта (Kaigler et al. 2006). Методы переноса генов могут обойти многие ограничения, связанные с доставкой белка в раневую поверхность мягких тканей (Giannobile 2002; Baum et al. 2003). Было показано, что факторы роста (Franceschi et al. 2000; Krebsbach et al. 2000; Jin et al. 2004)) или растворимые формы рецепторов цитокинов (Taba et al. 2005), применяемые путем переноса генов, более устойчивы, чем белки, используемые однократно. Таким образом, генная терапия может достичь большей биодоступности факторов роста в ранах пародонта и, таким образом, обеспечить больший регенеративный потенциал.
Передовые подходы для регенерации опорных структур зуба а) применение трансплантата и факторов роста в области внутрикостного дефекта, использование биорезорбируемой мембраны b) применение генных модификаций для трансдукции факторов роста, продуцирующих клетки-мишени
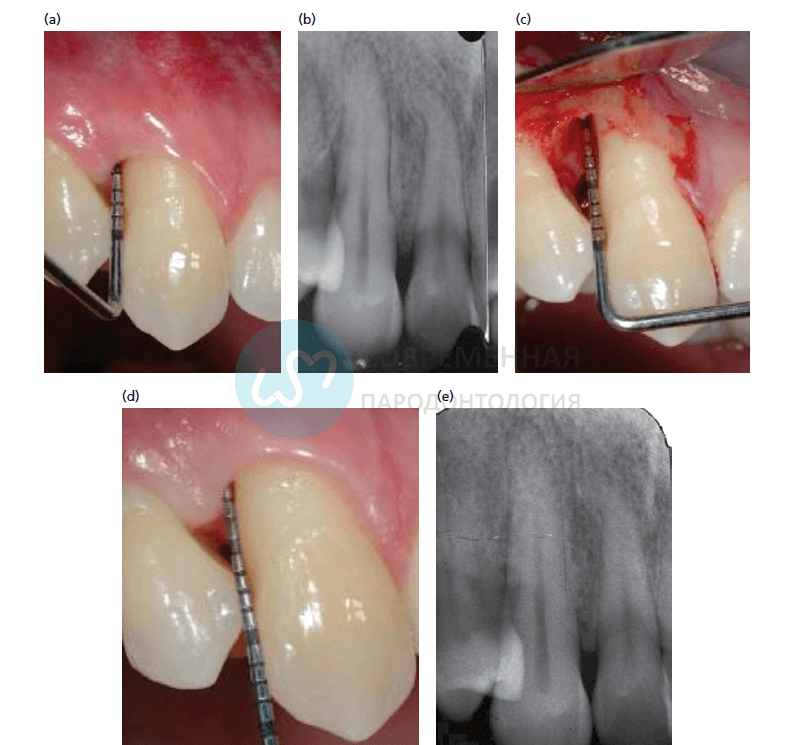
a -32‐летний пациент с тяжелым пародонтитом. Зуб 1.3 показывает измерения глубины кармана 10 мм, b- Периапикальная рентгенография показывает внутрикостный дефект дистальнее зуба 1.3, с -после буккального разреза сосочка сохраняется межзубная ткань, прикрепленная к небному лоскуту, d- После удаления грануляций и обработки корня, дефект классифицируется и измеряется: 7 мм глубиной трехстеночный дефект. Через год после хирургического вмешательства дистальный участок зуба 1.3 показывает глубину зондирования 2 мм, e- на рентгенограмме показано заполнение дефекта.
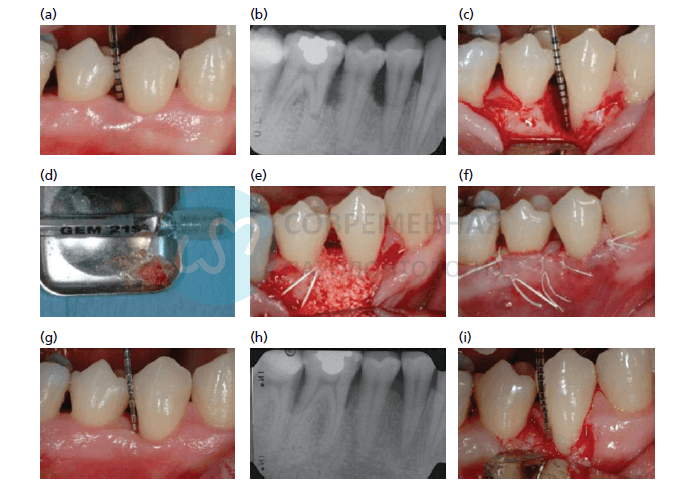
a-27‐летний пациент во время осмотра, три участка с глубиной зондирования (PPD) <6мм; один карман дистальнее зуба 4.4 имел PPD= 7 мм при отсутстивии десневой рецессии, б- периапикальная рентгенограмма показывает дефект одной стенки дистальнее зуба 4.4 и деструкцию между зубами 4.5 и 4.6. с- измерение очищенного одностеночного дефекта показывает глубину внутрикостного кармана 6 мм, d- введен материал GEM 21S®, предварительно смешивается с несколькими частицами аутогенной костной стружки, собранной из области вмешательства с помощью инструмента Rhodes, и с жидким компонентом GEM 21S® (тромбоцитарного происхождения фактор роста (PDGF), e- жидкий PDGF помещается в дефект вместе с трансплантатом для восстановления утраченной кости. f- швы накладываются для сохранения и стабилизации коронального лоскута. Второй внутренний шов выполняется с помощью 7-0 GorTex®, он позволяет оптимально адаптировать края лоскута без вмешательства со стороны эпителия. Два внутренних матрасных швы накладываются, но не завязываются до тех пор, пока рана не будет полностью закрыта без натяжения. Два дополнительных шва необходимы для того, чтобы обеспечить стабильный контакт. Мезиальный и дистальный сосочки стабилизируется дополнительными узловыми швами. g- через девять месяцев после операции PPD составляет 2 мм ,h- периапикальная рентгенограмма показывает хорошее заполнение костью одностеночного костного дефекта, а хирургическая ревизия показывает образование новой кости (i).
Заключение
Процесс заживления пародонта регулируется сложным многофакторным механизмом, в котором количество локальных и системных, микро- и макро- переменных сред взаимодействуют, чтобы обеспечить окончательный результат. Только глубокое понимание биологических и клинических компонентов, влияющих на исход десневых и пародонтальных хирургических вмешательств, позволит врачам эффективно манипулировать определяющими факторами, чтобы оптимизировать результат и увеличить предсказуемость регенерации периодонта. Этот материал дает краткое представление о механизмах заживления, которые запускаются в тканях пародонта после основного хирургического вмешательства. Сложность клеточных и молекулярных событий, которые активируются во время и после вмешательства на пародонте приводит к некоторым важным выводам:
• Как врачи, мы должны минимизировать любые отклонения от строгих хирургических протоколов, чтобы минимизировать риск каких-либо неблагоприятных последствий
• Как исследователи, мы должны быть в состоянии интерпретировать клинические признаки и симптомы на уровне физиологии и гистологии, и понять их природу, чтобы своевременно сменить тактику лечения.
Перевод оригинального материала «Periodontal Wound Healing» Hector F. Rios, D. Kaigler, Christoph A. Ramseier, G. Rasperini, William V. Giannobile
Michigan Center for Oral Health Research, Department of Periodontics and Oral Medicine,
University of Michigan School of Dentistry, Ann Arbor, MI, USA
Department of Periodontology, School of Dental Medicine, University of Berne, Berne, Switzerland
Department of Biomedical, Surgical and Dental Sciences, Foundation IRCCS Ca’ Granda Polyclinic,
University of Milan, Milan, Italy
выполнен Анной Матлаковой.
