Дентальные имплантаты являются надежным методом лечения для реабилитации пациентов с полным или частичным отсутствием зубов. Тем не менее, с имплантацией может быть связан ряд осложнений, которые могут возникать в различные временные периоды. Именно поэтому здоровье тканей, окружающих имплантат, важно поддерживать на всех этапах реабилитации пациентов.
На сегодняшний день выделяют ранние и поздние отторжения имплантатов. Последние в основном связаны с так называемыми биологическими осложнениями, хотя в некоторых случаях возможны и механические повреждения, включающие перелом тела имплантата или винта, его повреждение или деформация супраструктур.
Под биологическими осложнениями подразумевается 2 наиболее распространенных проблемы после установки имплантатов, а именно периимплантный мукозит и периимплантит.
Периимплантный мукозит проявляется как воспаление мягких тканей вокруг имплантата без сопутствующей потери костной ткани. Это обратимое состояние, однако, если им пренебречь, оно может прогрессировать до периимплантита, более серьезной проблемы, характеризующейся как воспалением, так и прогрессирующей потерей костной ткани. Распространенность периимплантного мукозита и периимплантита составляет приблизительно 20% и 45% соответственно по данным разных авторов, в то же время потеря имплантата может варьироваться от 0 до 14% на уровне пациента. В большинстве случаев именно накопление зубных отложений является основным этиологическим фактором. В то же время такие факторы, как установленный диагноз пародонтита в прошлом, неоптимальный домашний уход и отсутствие регулярной поддерживающей терапии в области установленных имплантатов (SPIC), могут повысить риск развития периимплантита.
Учитывая высокую распространенность заболеваний в области имплантатов, любой пациент, прошедший реабилитацию с помощью имплантации, в конечном итоге может столкнуться с этими осложнениями. Таким образом, здоровье тканей, окружающих имплантат, зависит от обеспечения соответствующих профилактических мер и вмешательств, которые включают
- оценку и мониторинг состояния тканей в области имплантата;
- укрепление здоровья полости рта в целом и периимплантной зоны в частности, изменение поведения, контроль факторов риска и лечение системных заболеваний (например, диабета);
- периодическое профессиональное удаление отложений в рамках SPIC, включая устранение факторов, способствующих образованию зубного налета;
- лечение периимплантных патологий.
Последовательная реализация программы SPIC не только способствует поддержанию здоровья периимплантных тканей, но и способствует предотвращению возникновения периимплантных патологий, особенно в группах высокого риска.
Врачи общей стоматологической практики играют основополагающую роль в обеспечении SPIC. Тем не менее, исследования показывают отсутствие уверенности и недостаток знаний среди стоматологов при диагностике и лечении ранних стадий патологий периимплантной зоны. Например, в Великобритании около 13% стоматологов общей практики сообщают, что избегают зондирования вокруг имплантатов из-за страха возникновения осложнений или потенциальных медико-юридических последствий, в то время как 14% не осматривают зону имплантатов вообще.
В данном обзоре будут обобщены данные литературных источников о том, как поддерживать здоровье тканей, окружающих имплантат и этапы SPIC с акцентом на данные о критических факторах, которые необходимо учитывать при ведении пациентов с имплантатами в общей стоматологической практике.
Здоровье тканей, окружающих имплантат: точка отсчета
Недавно Европейская федерация пародонтологии (EFP) опубликовала клинические рекомендации по ведению пациентов, которым были установлены дентальные имплантаты. Там говорится, что профилактика должна начинаться во время планирования операции и продолжаться на этапе хирургической установки и фиксации постоянной конструкции (примордиальная профилактика). На этом этапе профилактика направлена на консультирование пациентов и контроль любых факторов риска (например, плохой контроль зубного налета, нестабильный пародонтит и уровень гликемии). После установки имплантатов следует планировать индивидуально подобранную программу SPIC, включающую периодическую оценку состояния периимплантных тканей и контроль известных и выявленных факторов риска с помощью самостоятельного и профессионального удаления биопленки (первичная профилактика). Эти шаги должны быть направлены как на пациентов, где речь идет о здоровье тканей, окружающих имплантат, так и тех, у кого были ранее диагностированы/ пролечены патологии этой зоны. В последнем случае необходимо предотвратить рецидив и прогрессирование заболевания, чтобы избежать потери имплантата (вторичная и третичная профилактика). Участие стоматологов общей практики на всех этапах лечения, включая раннее выявление заболеваний и направление к врачам-пародонтологам для получения более специализированной помощи, является ключевым фактором профилактики.
Информирование пациентов
Существует мнение, что пациенты, рассматривающие реабилитацию с помощью имплантатов, предъявляют завышенные ожидания и считают, что имплантаты – это «беззаботное» лечение, которое не требуют такого же тщательного ухода, как естественные зубы. Поэтому в обязанности стоматолога/ стоматологического гигиениста входит просвещение и мотивирование пациентов относительно значимости SPIC и домашнего ухода.
Кроме того, пациенты должны быть проинформированы о возможных осложнениях и последствиях прогрессирования периимплантного мукозита до периимплантита, а также о клинических признаках и симптомах (т.е. боль, кровотечение, нагноение), которые должны побудить их обратиться к своему стоматологу. Недавнее исследование показало, что только 32% пациентов сообщили о получении подобных инструкций. Среди них 33% получили рекомендации обратиться к стоматологу при возникновении жалоб, а 28,6% получили рекомендации использовать ополаскиватель для полости рта и улучшить гигиену полости рта. Это заставляет обратить внимание на потенциальную недооценку специалистами рисков, связанных с длительным воспалением. Было бы полезно, если бы вышеупомянутая информация была предоставлена пациенту в виде информационного буклета по уходу за имплантатами и заболеваниям периимплантной зоны.
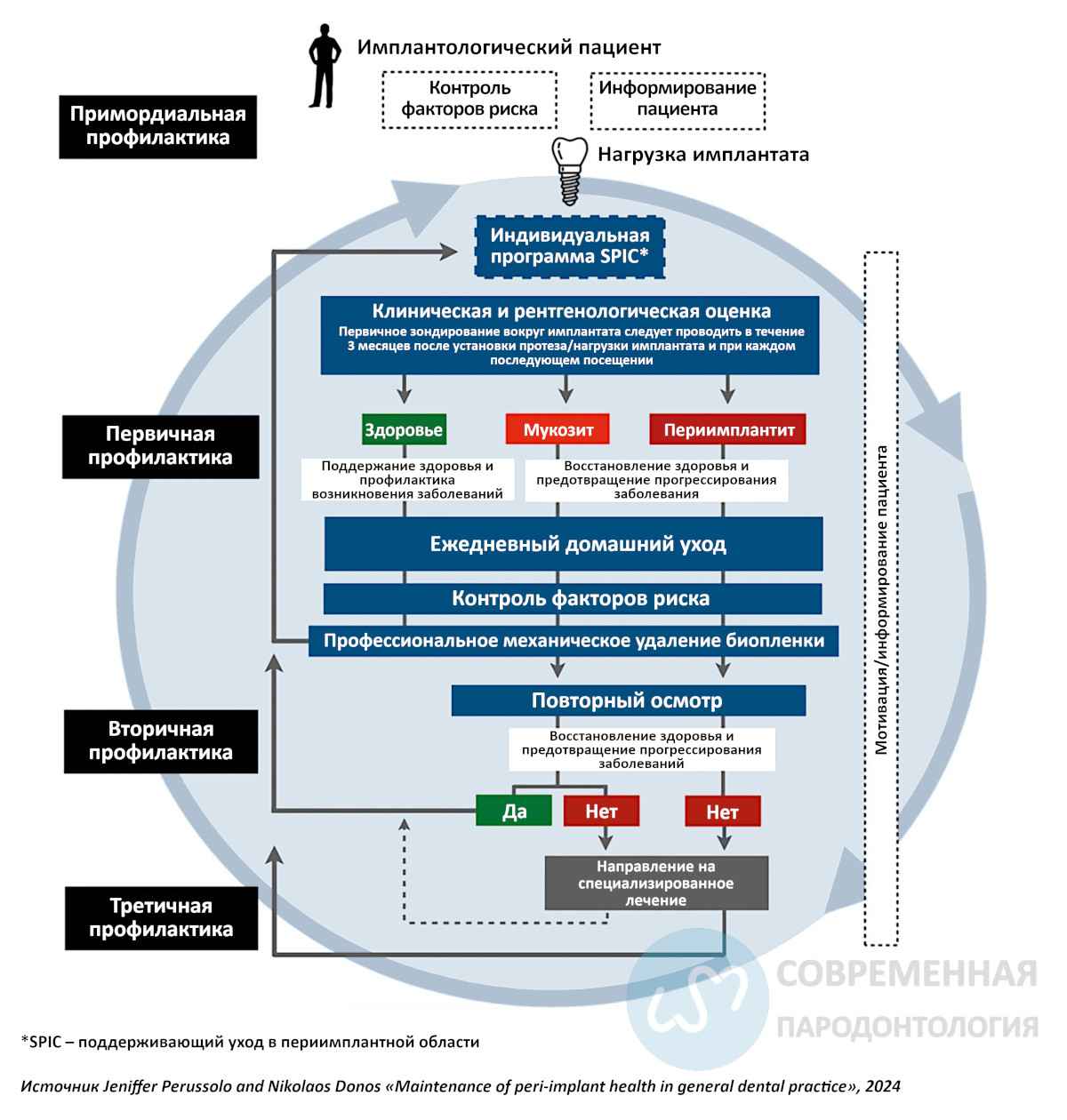
Рис.1. Эта блок-схема иллюстрирует различные этапы, связанные с поддержанием или восстановлением здоровья тканей, окружающих имплантат. Они основаны на установленном диагнозе и выполнении соответствующих профилактических мер и вмешательств. Примордиальная профилактика – это профилактика до и во время установки/нагрузки имплантата; первичная профилактика – это предотвращение
возникновения заболевания после установки и во время функционирования имплантатов; вторичная и третичная профилактика – направлены на предотвращение рецидивов и прогрессирования заболевания в местах, где оно было диагностировано и проведено лечение
Поддерживающий уход в области имплантатов
В предыдущих исследованиях SPIC называли как поддерживающий уход, поддерживающая терапия, поддерживающая периимплантная терапия. Индивидуальная программа включает 4 основных этапа на каждом приеме SPIC: мониторинг состояния тканей в области имплантата, укрепление здоровья полости рта посредством мотивации и воздействия на факторы риска, профессиональная гигиена полости рта и лечение участков с воспалением.
Клинический и рентгенографический мониторинг периимплантных тканей
Клиническая и рентгенографическая оценка периимплантных тканей должна включать
- визуальный осмотр слизистой оболочки в области имплантата для выявления возможных признаков воспаления;
- оценка кровоточивости при зондировании (BOP) и/ или нагноение;
- фиксацию изменений глубины зондирования, положения/ уровня маргинальной слизистой оболочки и уровня маргинальной кости.
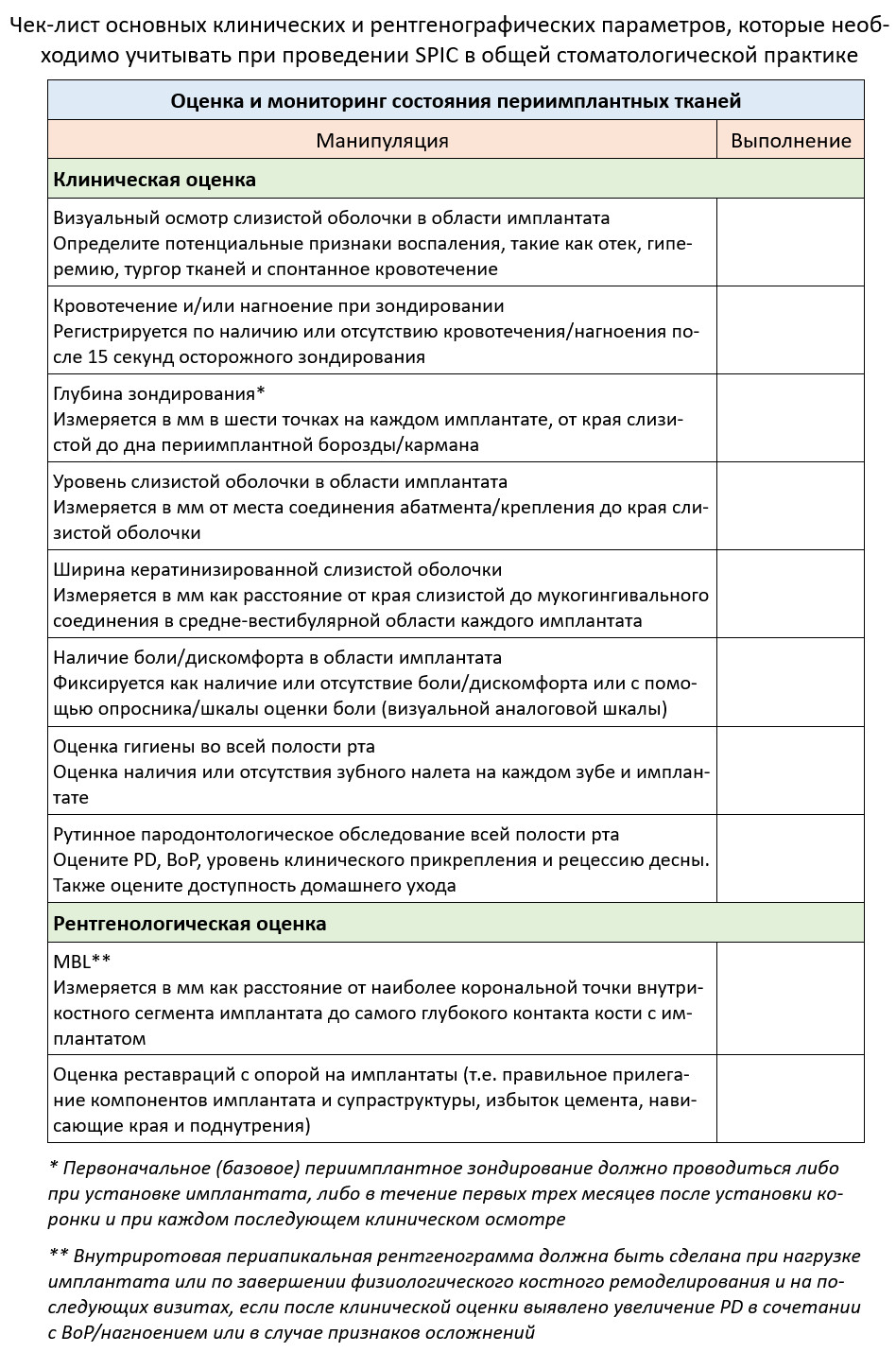
Индекс кровоточивости может быть рассмотрен в тех случаях, когда зондирование выполнить невозможно. Ширину периимплантной кератинизированной слизистой оболочки также следует зафиксировать, когда это возможно. Первоначальное (базовое) зондирование должно проводиться либо при нагрузке имплантата, либо в течение первых 3 месяцев после установки коронки и при каждом последующем клиническом осмотре, в идеале в шести точках в области каждого имплантата, используя пародонтальный зонд.
Кроме того, необходимо выполнить базовую внутриротовую периапикальную рентгенограмму в момент нагрузки имплантата или при завершении биологического ремоделирования кости. Это необходимо для фиксации уровня маргинальной костной ткани, измеряемой как расстояние от самой корональной точки внутрикостного сегмента имплантата до точки, где кость впервые контактирует с поверхностью имплантата (показано на рисунке ниже). При последующих посещениях рекомендуется выполнять внутриротовую рентгенограмму для оценки изменений маргинальной кости с течением времени, если после клинической оценки выявлено увеличение глубины зондирования в сочетании с кровотечением и/ или нагноением или при подозрении на механическое осложнение (например, ослабление винта или перелом).
Учитывая, что биопленка является основным этиологическим фактором периимплантита и наличие в анамнезе заболеваний пародонта повышает вероятность развития периимплантита, следует также регистрировать показатели гигиены вместе с рутинным пародонтологическим обследованием всей полости рта. Зубной налет можно обнаружить и измерить объективно с помощью пародонтального зонда или окрашивающих средств.
Кроме того, недавнее исследование показало, что в около 70% случаях, где в области имплантатов было менее 2мм кератинизированной слизистой и диагностирована патология периимплантной зоны, в той или иной степени проявлялся дискомфорт при чистке зубов во время контролируемой гигиены. Поэтому, когда отмечается подобный дискомфорт, необходимо провести тщательную оценку состояния периимплантных тканей.
Информация, собранная во время обследования, важна для понимания того, как поддержать здоровье тканей, окружающих имплантат, а также поставить соответствующий диагноз. В 2017 году Американская академия пародонтологии и EFP провели совместный симпозиум, где помимо разработки новой классификации, были разработаны критерии по диагностике заболеваний периимплантной зоны, которые недавно были обновлены в рамках новых клинических рекомендаций.
Важно подчеркнуть, что сложно определить диапазон глубины зондирования, совместимый со здоровьем периимплантной зоны, поскольку размеры слизистой оболочки могут меняться из-за положения имплантата (например, глубоко установленные имплантаты). Кроме того, объем физиологического ремоделирования кости может варьироваться из-за различных типов конструкций имплантатов, особенностей поверхности, хирургических и ортопедических протоколов. Именно с этим связано то, что клиницисты должны получить исходные данные зондирования и рентгенограммы после установки имплантата. Это помогает отслеживать изменения в периимплантной области с течением времени. В таблице ниже представлен список параметров, на которые следует обращать внимание во время приема SPIC.
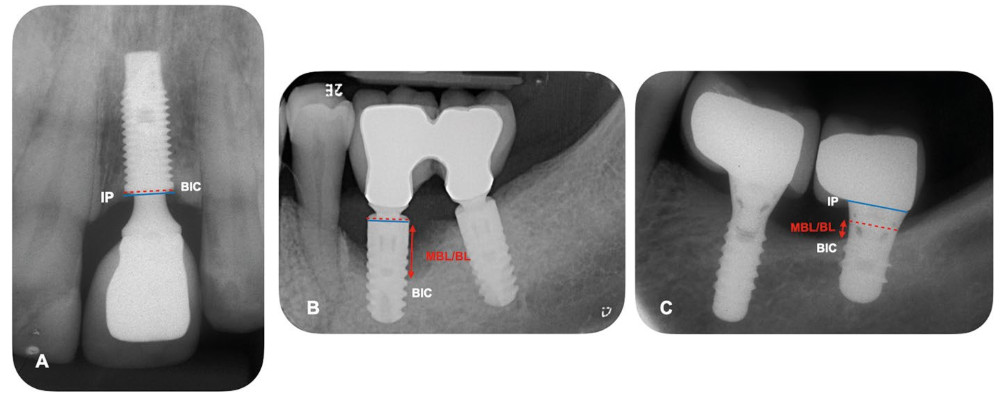
Рис.2. Периапикальные рентгенограммы, показывающие MBL/BL (маргинальный уровень кости/потеря кости) в области имплантатов.
a, b, c — измеряется как расстояние от наиболее корональной точки внутрикостного сегмента (пунктирная красная линия) имплантата или платформы имплантата (IP) (синяя линия) до самого глубокого контакта кость-импланта (BIC).
c — имплантаты устанавливаются так, чтобы шероховатая поверхность имплантата доходила до гребня кости, а гладкая шейка соприкасалась с мягкими тканями. Следовательно, любая потеря костной массы, происходящая до границы раздела гладкой и шероховатой поверхности (красная пунктирная линия), может рассматриваться как физиологическое ремоделирование, в то время как потеря костной массы, происходящая апикальнее этой точки, может рассматриваться как патологическая
Таблица 1
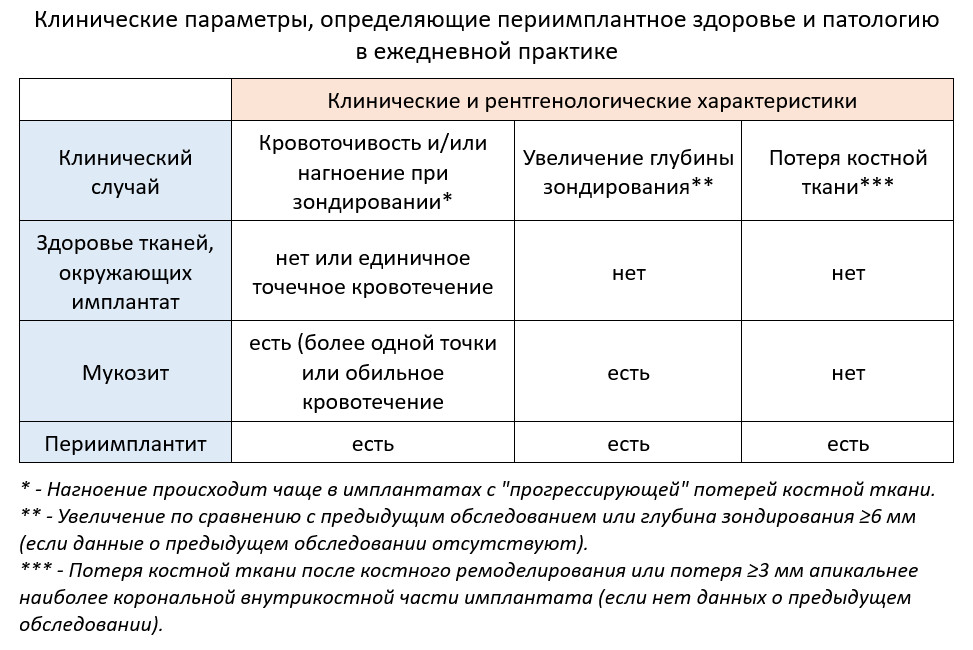
Таблица 2
Гигиена полости рта и ежедневный уход
Роль биопленки в возникновении воспалительной реакции и прогрессировании потери маргинальной кости вокруг имплантатов была широко описана. Следовательно, самоконтроль пациента за формирование налетом является одним из ключевых факторов для профилактики развития и лечения периимплантных патологий. Недавнее исследование показало, что хотя более 90% исследуемых научились чистить зоны, где установлены имплантаты, только 40% действительно делали это под наблюдением стоматолога. Пробелы в знаниях о домашнем и профессиональном уходе сохраняются до сих пор, при этом некоторые пациенты опасаются, что самостоятельный уход может повредить имплантаты. Эти данные подчеркивают важность оценки домашней гигиены у пациентов для выявления факторов, которые могут поставить под угрозу адекватный уход. К ним относят прежде всего недостаточный или неадекватный доступ и наличие факторов, способствующих образованию зубного налета. Помимо периодического инструктажа пациентов, важно показывать и обучать использованию различных предметов гигиены. Кроме того, пациентов следует расспрашивать о наличии боли/ дискомфорта во время гигиены и гиперчувствительности в соседних зубах, поскольку эти факторы могут препятствовать проведению адекватного ухода. Для пациентов с ограниченными возможностями или специальными потребностями, ухаживающие за ними лица также должны быть проинформированы о важности поддержания оптимального уровня гигиены, им необходимо предоставить подробные инструкции по этому вопросу.
В настоящее время существует множество устройств/ предметов гигиены, в том числе зубные щетки (мануальные, ротационные электрические, звуковые, монопучковые), ершики, зубные нити, зубные пасты, ирригаторы и ополаскиватели для полости рта, которые должны быть подобраны и использоваться в соответствии с потребностями конкретного пациента.
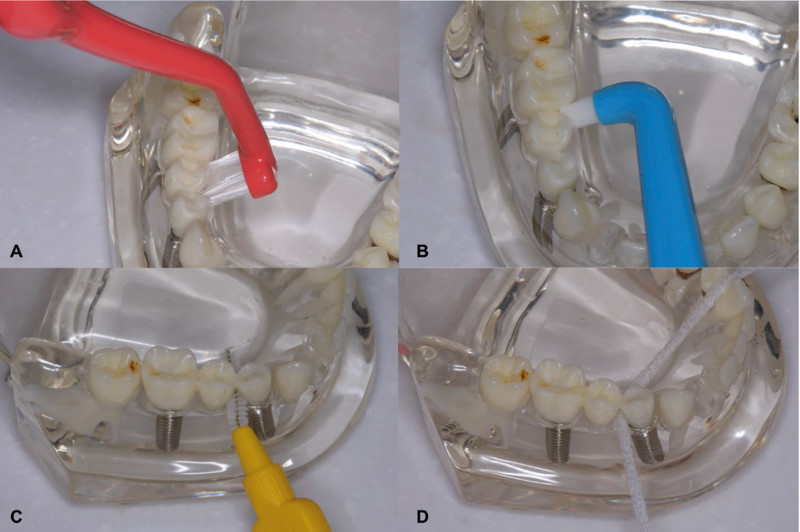
Рис.3. Пример предметов гигиены для ухода за имплантатами.
A) Зубная щетка для имплантатов с изгибом, которая обеспечивает наилучший доступ к труднодоступным участкам
B) Монопучковая щетка
C) Ершик
D) Супер-флосс
Зубная щетка
Согласно современным данным, до сих пор не существует единого стандарта ухода за имплантатами, и до сих пор не определено, какой тип зубной щетки (например, мануальная или электрическая), с какой частотой и продолжительностью необходимо использовать для того, чтобы поддержать здоровье тканей, окружающих имплантат и снизить риски рецидива заболевания. Тем не менее, ротационные электрические зубный щетки продемонстрировали по данным исследований лучшие результаты в плане разрешения воспаления и выживаемости имплантатов по сравнению с ручной зубной щеткой. Примечательно, что электрические щетки улучшили гигиену и в менее доступных интерпроксимальных участках по сравнению с чисткой мануальной щеткой и в более доступных (щечных и язычных) участках. Пациенты, которые не умеют пользоваться ручной зубной щеткой, или люди с ограниченными возможностями, могут извлечь особую пользу от использования электрической зубной щетки для улучшения показателей гигиены. При сравнении ручных и звуковых зубных щеток, разницы не было выявлено, при этом обе зубные щетки способствовали поддержанию здоровья периимплантных тканей в течение 1 года наблюдений.
Что касается частоты чистки зубов, не было отмечено влияния на показатели глубины зондирования, кровоточивости и потери маргинальной кости.
Независимо от частоты и типа используемой зубной щетки, обучение пациентов навыкам гигиены необходимо для того, чтобы поддержать здоровье тканей, окружающих имплантат. Поэтому, особенно для пациентов, проходящих лечение периимплантита, рекомендуется индивидуальный режим чистки имплантатов и зубов два раза в день с использованием электрической или ручной зубной щетки.
Гигиена интерпроксимальной области
На сегодняшний день традиционные ручные методы удаления межзубного зубного налета (такие как зубная нить, ершики) считаются клиническим стандартом лечения. Зубные нити следует использовать с осторожностью, особенно вокруг имплантатов с оголенными витками, чтобы предотвратить осаждение волокон зубной нити на поверхности имплантатов, что может привести к воспалению околоимплантой области и потере костной ткани. Кроме того, растет интерес к поиску устройств, способных преодолеть проблемы очистки реставраций с опорой на имплантаты. Это привело к созданию альтернативных форм и дизайна ершиков.
Ирригаторы для полости рта представляют собой электрические устройства, которые подают пульсирующую жидкость под контролируемым давлением. Они особенно эффективны вокруг конструкций на имплантатах, где ограничен гигиенический доступ или у пациентов с ограниченной ловкостью рук. Ирригаторы полости рта могут привести к большему снижению кровотечения (81,8%) по сравнению со зубной нитью (33,3%). При использовании в качестве дополнения к двухразовой ежедневной чистке зубов, они приводят к улучшению клинических и биохимических показателей по сравнению с ершиками и только ручной чисткой зубов. Добавление антисептиков вместо воды, например, 0,06% хлоргексидина, показало повышение эффективности ирригации, уменьшение воспаления и уменьшение тяжести течения мукозита. Однако некоторые пользователи могут испытывать боль и трудности при использовании ирригаторов полости рта. Консультирование пациентов по вопросам ежедневной интерпроксимальной гигиены является важным условием долгосрочного здоровья периимплантной зоны. У пациентов с мукозитом, в дополнение к регулярной гигиене полости рта, можно рассмотреть возможность назначения ирригатора с водой.
Самостоятельное применение антисептиков
По данным разных авторов лечение с помощью профессионального механического удаления отложений, адекватный домашний уход и регулярное использование в полосканий 0,12% хлоргексидином два раза в день в течение двух недель, считается эффективным для уменьшения проявлений мукозита, но не устраняет воспаление полностью. Ежедневное использование 0,03% хлоргексидина и 0,05% цетилпиридиний хлорида (CPC) в качестве дополнения к механическому удалению зубного налета продемонстрировало преимущества в снижении кровоточивости при зондировании и общего количества бактериальной обсеменённости вокруг имплантатов. Тем не менее, доля случаев разрешения мукозита вокруг имплантатов была одинаковой среди пациентов, которые использовали и не использовали данную схему лечения (58,3% и 50%, соответственно). Одним из недостатков использования 0,03% хлоргексидина и 0,05% CPC ополаскивателя является более высокий уровень окрашивания зубов или слизистой оболочки языка.
Некоторые пациенты также могут испытывать ощущение жжения слизистой рта и изменение чувствительности. У пациентов с мукозитом использование геля с хлоргексидином в домашних условиях ежедневно в течение 2 недель, также показало уменьшение глубины зондирования через 6 месяцев наблюдения.
Ранее считалось, что химический контроль налета с помощью ополаскивателей для рта не дает дополнительных преимуществ по сравнению с механическим удалением отложений. Однако в клинических рекомендациях уровня S3 предлагается, что самостоятельное применение антисептических ополаскивателей полости рта под профессиональным контролем в качестве дополнения к профессиональному механическому удалению отложений (PMPR) может быть полезным, особенно для пациентов с периимплантным мукозитом.
Контроль факторов риска
Выявление, контроль и мониторинг факторов риска, связанных с возникновением и прогрессированием периимплантных патологий, очень важен. Убедительные доказательства подтверждают, что пародонтит в анамнезе, неадекватный домашний уход и нерегулярный SPIC — это факторы риска развития патологий в области имплантатов. Предыдущие исследования показали, что у пациентов, предрасположенных к развитию и пародонтитом в анамнезе отмечается более высокий риск развития периимплантита. Таким образом, важно уделять первоочередное внимание не только уходу за имплантатами, но также давать оценку уходу за тканями пародонта, а также заниматься вопросами просвещения пациентов о важности сохранения достигнутой стабильности пародонта.
Различные исследования показали, что длительная гипергликемия, наблюдаемая у пациентов с сахарным диабетом, может привести к стойкой местной и системной воспалительной реакции. Более высокие показатели распространенности периимплантита и потери костной ткани наблюдались с течением времени у пациентов с неконтролируемым диабетом по сравнению с пациентами с хорошим гликемическим контролем. Тем не менее, до сих пор не ясно, повышает ли диабет риск развития периимплантных заболеваний. Независимо от этого, пациенты с диабетом должны быть проинформированы о потенциальном риске развития периимплантных заболеваний и важности гликемического контроля до, во время и после лечения.
Было доказано, что курение также оказывает негативное воздействие на ткани периимплантной зоны, что приводит к более частому возникновению мукозита (48,6% против 43,9%) и периимплантита (30,5% против 19,7%) у нынешних курильщиков по сравнению с бывшими курильщиками. Была обнаружена четкая взаимосвязь между продолжительностью курения и повышенным риском развития периимплантита. Несмотря на ограниченные данные о влиянии курения, включая электронные сигареты, на ткани периимплантной зоны, пациенты должны быть проинформированы о потенциальных рисках и вредных последствиях. Рекомендована реализация соответствующих мероприятий по мотивированию отказу от курения для всех курильщиков.
Кроме того, рекомендуется принимать во внимание и другие местные факторы, такие как наличие фиксирующего цемента в подслизистой зоне и реставраций, затрудняющих домашний уход, которые оказывают негативное влияние на здоровье периимплантной области. В повседневной клинической практике нередко можно встретить имплантаты, установленные в менее оптимальных условиях, и с ортопедическими конструкциями, не обеспечивающие адекватных доступ для гигиенического ухода. Отмечено, что у большинства имплантатов с развившемся периимплантитом затруднен доступ к домашней гигиене. Следовательно, при протезировании необходимо создавать такой профиль конструкций, который предотвращает накопление налета и воспаление тканей. При необходимости протезы могут быть сняты для чистки и коррекции, обеспечивая тем самым надлежащий доступ для гигиены.
Недостаточная ширина кератинизированной слизистой (менее 2 мм) также ассоциируется с более высоким риском развития воспалением мягких тканей, рецессией слизистой оболочки и маргинальной потерей костной ткани вокруг имплантатов. Таким образом, у пациентов с имплантатами и дефицитом кератинизированной слизистой и жалобами на боли при домашней гигиене в этой области, а также рецидивирующее воспаление или усиление рецессии слизистой оболочки около имплантата, может быть рассмотрено увеличение зоны кератизированной слизистой путем хирургического вмешательства. При этом всегда важно оценить риски и преимущества вмешательства и выявить все потенциальные факторы, способствующие воспалению и наличию жалоб на боль при чистке в этой области. Хотя доказанная связь между увеличением толщины слизистой оболочки в области имплантатов и профилактикой периимплантных заболеваний отсутствует, известно, что более толстые мягкие ткани ассоциируются с улучшением эстетики и уменьшением рисков рецессии слизистой оболочки в местах установки имплантатов.
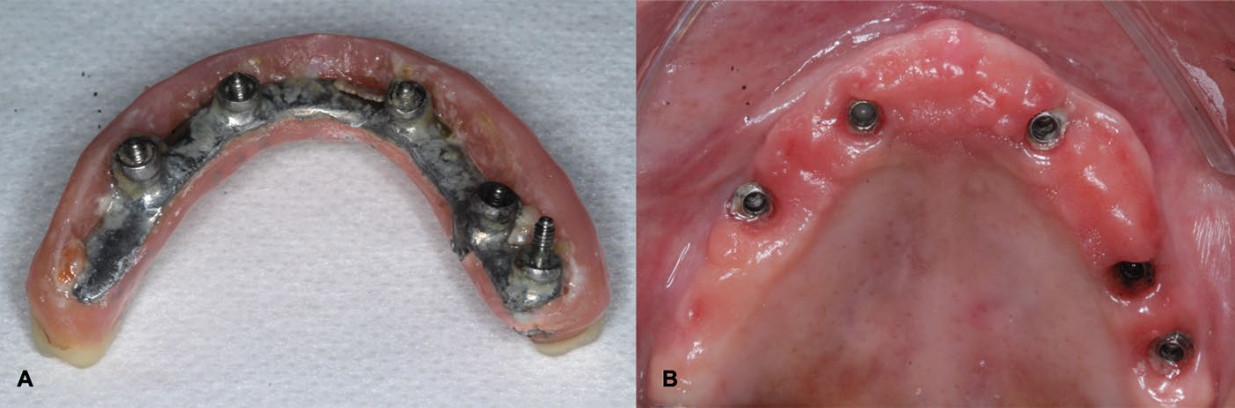
Рис.4. a, b — тотальная ортопедическая несъемная конструкция с опорой на имплантаты с плохим вестибулярным контуром и недостаточным доступом для гигиены, что привело к накоплению налета и воспалению мягких тканей
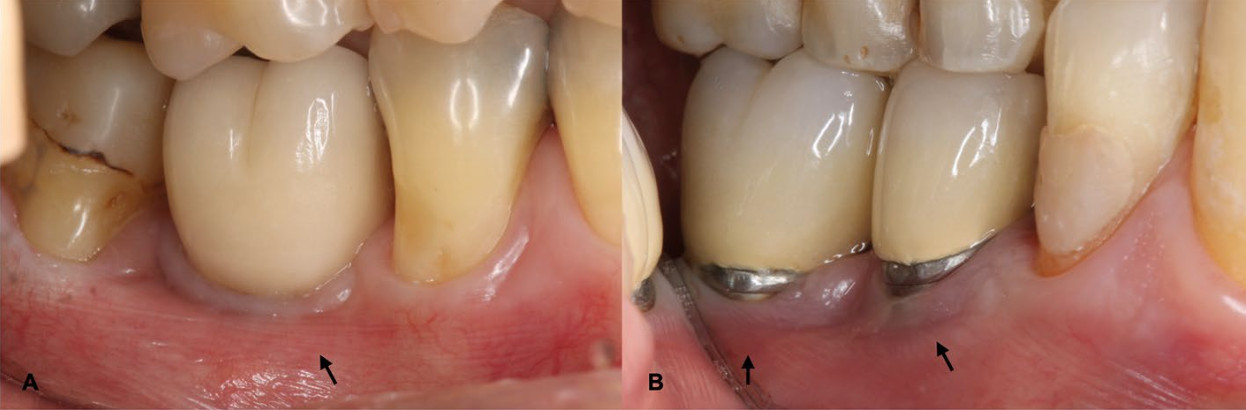
Рис.5. a, b — имплантаты в дистальном отделе нижней челюсти с недостаточной шириной кератинизированной слизистой (менее 2 мм)
Профессиональное удаление биопленки
Помимо составления индивидуального плана ухода за полостью рта, необходимо также провести профессиональное удаление отложений в области имплантата/ов и всего зубного ряда (PMPR). PMPR вокруг имплантатов включает в себя удаление над и подслизистых твердых и мягких отложений с поверхности имплантата и/или его супраструктуры, без повреждения обеих поверхностей с помощью различных инструментов. При мукозите и периимплантите, нехирургическое пародонтологическое лечение (NSPT) должно проводиться как необходимый шаг для снятия воспаления. В зависимости от реакции тканей периимплантной зоны, проводится дополнительное NSPT или хирургическое лечение.
В литературе описан целый ряд инструментов, которые могут быть использованы во время SPIC. Часто поддерживающая терапия выполняется с помощью комбинацией ручных (титановых, тефлоновых кюрет из углеродного волокна и пластика) и инструментов с механическим приводом, таких как звуковые/ ультразвуковые устройства, воздушно-полировочные системы и лазеры, с или без вспомогательной антимикробной терапии. Выбор инструментов должен также должен основываться на клинической оценке и на основе индивидуальных требований к случаю.
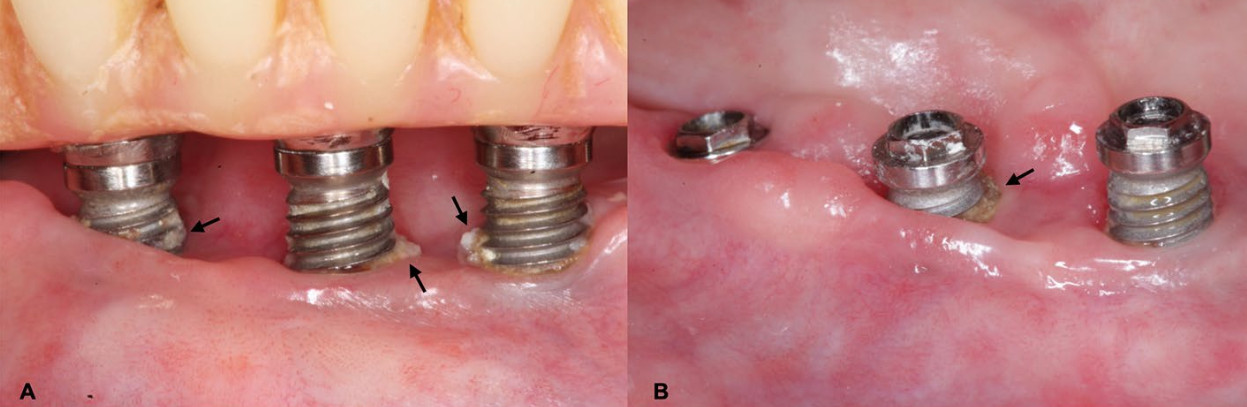
Рис.6. a, b — имплантаты с открытыми поверхностями витков, что способствует накоплению налета и образованию камней (указано стрелками)
Ручные инструменты и аппаратное лечение
Кюреты из титана и углеродного волокна могут эффективно удалять небольшие и умеренные кальцифицированные зубные отложения с поверхности имплантатов и приводят к меньшему повреждению поверхности по сравнению с металлическими. В отличие от них, пластиковые кюреты могут не обладать достаточной прочностью и размером для выполнения подобных задач. Обычные стальные инструменты могут значительно «царапать» поверхность имплантата, способствуя тем самым накоплению налета. Следовательно, их использование должно быть ограничено удалением камня без контакта с поверхностью имплантата. Ультразвуковые инструменты с различными наконечниками (например, с пластиковым, углеродным покрытием) могут использоваться для удаления надслизистых и подслизистых камней и биопленки, и они более эффективны, чем ручные пластиковые кюреты. Биопленка также может быть удалена с помощью резиновых чашечек и полировочной пасты или устройств для воздушной полировки.
Устройства для воздушной полировки были представлены как безопасная и эффективная альтернатива для удаления надслизистой и подслизистой биопленки с поверхности имплантатов и естественных зубах, предполагая, что они вызывают менее выраженные изменения поверхности из-за менее абразивных свойств глицина. Конструкция рабочего наконечника позволяет порошку течь вертикально, обеспечивая доступ к визуально неконтролируемым или недоступным участкам. Существуют различные устройства для воздушной полировки, но те, в которых используется пониженное давление воздуха для подачи порошка на основе глицина и воды, продемонстрировали снижение количества отложений, воспаления и количества карманов ≥4 мм в течение 12 месяцев наблюдения.
В рандомизированных контролируемых исследования сравниваются различные подходы в рамках SPIC, в частности в одном из них сравнивалась эффективность использования кюрет с ультразвуковыми скейлерами или воздушно-полировочными девайсами в рамках 3-месячной программы SPIC. Было показано, что различные подходы не привели к значительным изменениям в BoP, что свидетельствует о том, что все они являются эффективными вариантами для того, чтобы поддерживать здоровье тканей, окружающих имплантат в краткосрочной перспективе.
Таким образом, конкретные рекомендации по типу используемого инструмента могут быть даны в зависимости от каждого конкретного случая. У пациентов с мукозитом, инструменты с механическим приводом (т.е. ультразвуковые аппараты с пластиковыми насадками, оборудование для воздушной полировки с использованием глицинового порошка, хитозановые щетки) или ручные инструменты могут рассматриваться как один вид PMPR. Комбинированное использование воздушно-полировочных систем или диодного лазера к традиционной PMPR может быть неоправданным из-за увеличения стоимости и возможности осложнений.
Для начального нехирургического лечения периимплантита рекомендуется использовать кюреты и/или звуковые/ультразвуковые аппараты. Несмотря на некоторое количество исследований, подтверждающих эффективность лазеров, воздушной полировки или антимикробной фотодинамической терапии, как в качестве дополнения, так и отдельно, имеются ограниченные данные о дополнительных преимуществах их применения.
У пациентов, уже прошедших лечение периимплантита, до сих пор неизвестно, какой режим PMPR в рамках SPIC наиболее эффективен для снижения частоты рецидивов заболевания. Несмотря на это, для удаления биопленки можно использовать ручные кюреты, ультразвуковые инструменты и устройства для воздушной полировки по отдельности или в комбинации.
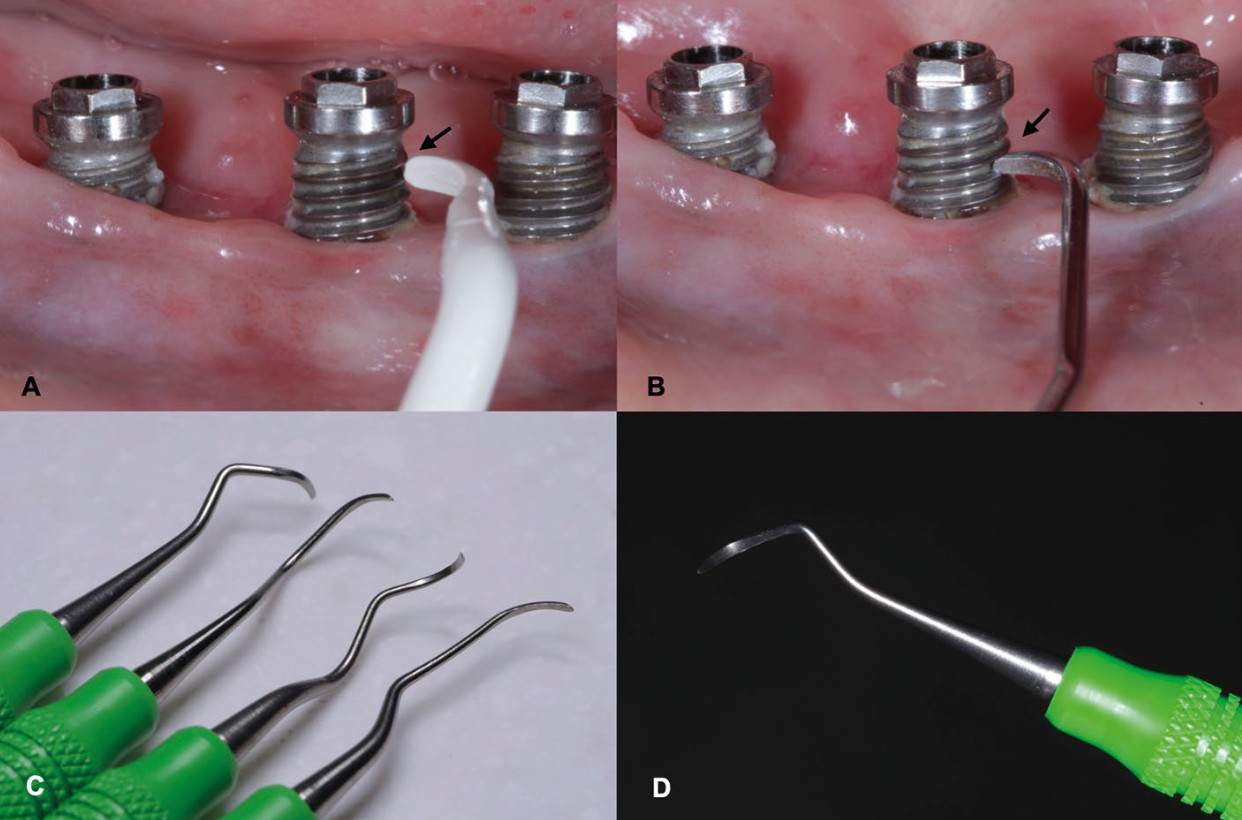
Рис.7. Ручные инструменты для нехирургического лечения в рамках поддерживающего ухода.
Доступность удаления отложений и адаптация ручных и механических инструментов к поверхности имплантата часто может быть затруднена.
а) пластиковая кюрета с рабочей частью такого размера, которая не подходит для правильной адаптации инструмента;
b) обычные кюрета из нержавеющей стали имеет меньший размер рабочей части и легко адаптируются, но может оставить серьезные повреждения на поверхности имплантата и способствовать дальнейшему накоплению налета;
c, d) титановые кюреты имеют маленькую рабочую часть и достаточная прочность для удаления кальцифицированных отложений на имплантатах.
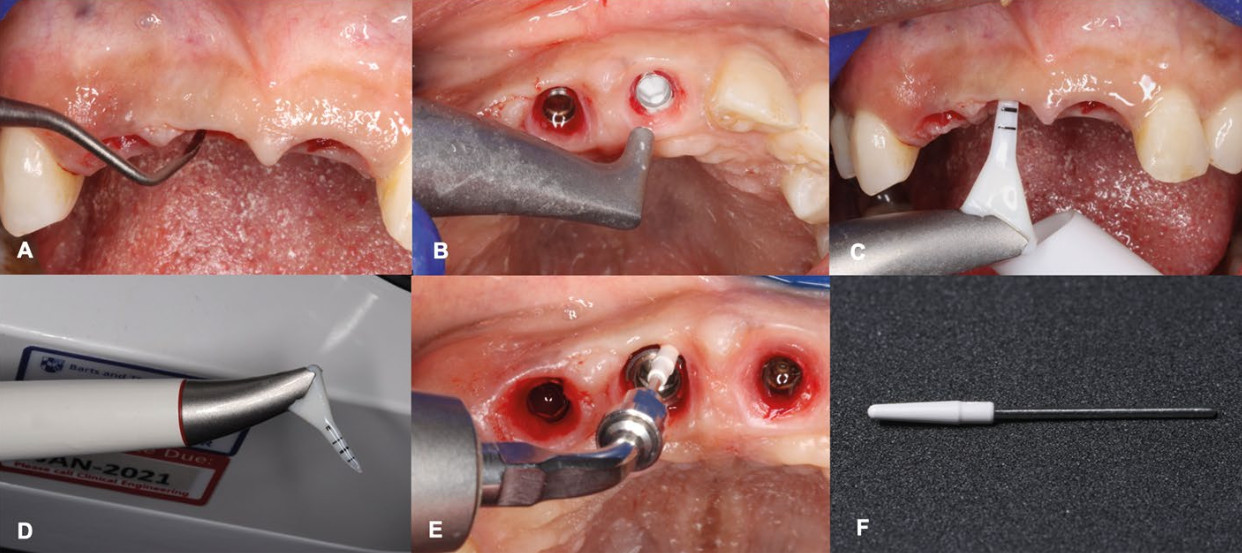
Рис.8. Последовательность нехирургической обработки с использованием воздушно-полировочной системы на основе глицина
а) первоначальное удаление биопленки и камня с помощью титановой кюреты;
b) удаление как надслизистой, так и подслизистой биопленки на глубину до 4 мм с помощью воздушно-полировочного девайса с использованием порошка на основе глицина;
c) для удаления биопленки из карманов глубиной более 4 мм используется тонкая пластиковая насадка;
d) для подачи порошка;
e) для тщательной и безопасной очистки чувствительных поверхностей абатментов и реставраций на ультразвуковом аппарате используется специальная насадка с полиэфирным покрытием (f) позволяет проводить обработку на глубину до 3мм.
Дополнительное использование местных или системных средств
Хотя профессиональное применение антибиотиков (местно или системно) или местных антисептических средств, таких как хлоргексидин может дать эффект в качестве дополнения к PMPR, особенно в тех участках, где слабый ответ на проводимое лечение или имеются рецидивы, в большинстве исследований отмечается ограниченный дополнительный эффект в снижении клинических признаков воспаления при мукозите. Поэтому местное и системное применение антибиотиков при мукозите, а также системное применение антибиотиков во время нехирургического лечения периимплантита, не рекомендуется из-за влияния их применения на здоровье населения и рисков антибиотикорезистентности.
Кроме того, профессиональное местное применение антисептиков во время нехирургического лечения мукозита и периимплантита, а также в рамках SPIC, обычно не рекомендуется из-за недоказанной пользы такого назначения. Однако всегда важно рассматривать каждый случай индивидуально, принимая во внимание другие состояния здоровья или риски. Использование других дополнительных назначений и рекомендаций, таких как пробиотические препараты, содержащие Lactobacillus reuteri, также может быть рассмотрено при лечении периимплантного мукозита. По некоторым данным пробиотики могут дать определенную пользу, модулируя микробиоту полости рта и ответную реакцию организма и уменьшая признаки воспаления в течении 3 месяцев наблюдения.
Клинические контрольные точки терапии
Хотя лечение патологий периимплантной зоны не входит в рамки данного обзора, важно учитывать, что нехирургические вмешательства часто оказываются эффективными в борьбе с мукозитом, но также имеют свои ограничения при лечении большинства случаев периимплантита. Если после нехирургического этапа лечения периимплантита, сохраняются глубокие карманы (>5 мм), а также кровоточивость при зондировании в более чем одной точке и/или имеется нагноение, может потребоваться дополнительное хирургическое вмешательство. После завершения лечения программу SPIC всегда следует пересмотреть.
Для тех случаев, когда лечение проводилось по поводу мукозита, конечной точкой является оценка BoP ≤1 балла и отсутствие нагноения, оцениваемое через 2-3 месяца после терапии. Если воспаление разрешилось, рекомендуется повторный прием для проведения SPIC. Если воспаление сохраняется (≥2 участков BoP, ≥1 участка с обильным кровотечением при зондировании или наличие нагноения), следует провести повторное лечение. При периимплантите конечные точки нехирургического и хирургического лечения следует оценивать через 6-12 недель и 6 месяцев соответственно. Конечной точкой лечения периимплантита считается достижение глубины зондирования ≤5 мм, ≤1 точка BoP, отсутствие нагноения и отсутствие прогрессирующей потери костной ткани.
Интервалы между приемами
Отсутствие SPIC представляет собой высокий риск развития периимплантита и потери имплантата, в то время как полное соблюдение рекомендованного интервала SPIC приводит к снижению риска осложнений. Предыдущий систематический обзор определил, что минимальный интервал между SPIC 5-6 месяцев для снижения вероятности развития биологических осложнений. Текущее клинические рекомендации EFP предлагает первоначальный 3-месячный интервал между приемами после лечения периимплантита, а затем 3-4-месячный интервал в течение первого года наблюдения. После этого интервал SPIC должен устанавливаться в каждом конкретном случае в зависимости от состояния пациента и его профиля риска, основанного в свою очередь на особенностях установленных имплантатов и ортопедических конструкций (например, предлагаются интервалы в 3, 6 или 12 месяцев). Для облегчения выбора необходимых интервалов между приемами пациентов и прогнозирования рисков развития периимплантных заболеваний, используется IDRA — система оценки риска развития заболеваний. Всегда важно напоминать пациентам о соблюдении интервалов SPIC и важности домашнего ухода, так как при отсутствии явных осложнений, пациенты становится менее бдительными в этом отношении. Кроме того, очень важно, чтобы стоматологи общего профиля проходили всестороннюю подготовку и обладали необходимыми знаниями для проведения SPIC, а также знали, когда следует направлять пациентов к специалистам.
Заключение
Регулярная и структурированная программа SPIC необходима для того, чтобы поддержать здоровье тканей, окружающих имплантат:
- Профилактические меры должны начинаться о установки имплантата и продолжаться на протяжении всей жизни пациента.
- Ключевые элементы индивидуальной программы SPIC должны включать мониторинг состояния и стабильности тканей периимплантной зоны, укрепление здоровья полости рта и эффективный контроль и управление факторами риска. Регулярное профессиональное удаление биопленки – это важнейший компонент.
- SPIC должен охватывать не только пациентов со здоровым тканями периимплантой зоны, но и тех, кто имеет поставленный диагноз или прошел соответствующее лечение мукозита или периимплантита.
По материалам Jeniffer Perussolo and Nikolaos Donos «Maintenance of peri-implant health in general dental practice», 2024
