Антибиотики – это лекарственные препараты, которые убивают или останавливают размножение бактериальных клеток при концентрациях, которые относительно безвредны для тканей хозяина, и, следовательно, могут быть использованы для лечения инфекций, вызванных бактериями. Термин был первоначально применен к природным веществам, продуцируемым некоторыми группами микроорганизмов, отличающимся от других антимикробных агентов, которые были синтезированы химически. Тем не менее, некоторые противомикробные соединения, первоначально обнаруженные как продукты жизнедеятельности микроорганизмов, могут быть полностью синтезированы химическими способами. Таким образом, в медицине и фармацевтике, антимикробные препараты, используемые в лечении бактериальных инфекций, в настоящее время обычно называют как антибиотики, интерпретируя слово буквально.
Антибиотики — это только одна группа противомикробных препаратов, которые также включают противовирусные, противогрибковые и противопаразитарные химические вещества. Способность препарата достигать зараженного участка и способность бактерий-мишеней сопротивляться или дезактивировать агент определяют эффективность терапии. На основании их действия в концентрациях, переносимых хозяином, антибиотики могут быть классифицированы как «бактерицидные» или «бактериостатические», и, в зависимости от диапазона восприимчивых бактерий, «узкого спектра» или «широкого спектра».
В конце 1930-х и начале 1940-х годов появление мощных препаратов, избирательно активных в отношении бактерий — сульфаниламидов, пенициллина и стрептомицина, — произвело революцию в лечении бактериальных инфекций. Выдающийся успех этих препаратов в лечении ранее опасных для жизни заболеваний заставил многих поверить, что бактериальные инфекции никогда больше не станут серьезной медицинской проблемой. Семидесятилетний опыт работы с этими и сотнями дополнительно разработанных противомикробных препаратов показал, что, несмотря на их успех, эта точка зрения была слишком оптимистичной. Проблемы, возникающие в результате широкого использования антибиотиков, изменили общее представление о возможностях антимикробных препаратов. Многие бактерии развили значительную способность противостоять или отталкивать антибиотики. Было отмечено, что антибиотики могут нарушать экологическое равновесие организма, что способствует размножению небактериальных микроорганизмов и устойчивых штаммов. Иногда это может инициировать новые инфекции, которые хуже, чем те, которые первоначально лечили. Антимикробные агенты могут иметь другие нежелательные свойства, такие как токсичность, которые также необходимо учитывать.
Цель этой главы — обсудить полезность системных и локально применяемых противомикробных препаратов в пародонтальной терапии. Учитывая ограничения механического лечения, использование антибактериальных средств может усиливать эффект терапии. Потенциальные выгоды должны быть сбалансированы с риском нежелательных эффектов.
Антибиотики: принцип применения в пародонтологии
Является ли пародонтит инфекцией и должен ли он рассматриваться как единое целое?
Распознавание пародонтита как инфекции, вызванной или поддерживаемой живыми бактериями, которые присутствуют в пораженных участках, является основополагающим для любой концепции противомикробного лечения. Антибиотики могут убивать или подавлять живые бактерии, но они не могут удалить зубной камень и бактериальные остатки, что традиционно считается неотъемлемой частью пародонтальной терапии. Постоянное присутствие больших масс бактерий на твердых поверхностях полости рта вызывает воспаление в соседних мягких тканях, таких как десна или слизистая оболочка. Бесспорна важность удаления бактериальных отложений для устранения гингивита или периимплантного мукозита. Склонность участков подвергаться дальнейшему разрушению пародонта, по-видимому, более специфична по своей природе, поскольку не все участки с гингивитом неизменно прогрессируют в пародонтит, и поскольку при поражениях пародонта обнаруживаются увеличенное количество и частота обнаружения подозреваемых патогенов.
Тем не менее, тщательная механическая очистка поверхности корня для удаления бактериальных отложений оказалась полезной для всех случаев пародонтита, независимо от типа или клинических условий. Кроме того, было показано, что эффективная гигиена, выполняемая самостоятельно для предотвращения восстановления бактериальных отложений, имеет важное значение для долгосрочной стабильности.
Однако этот способ лечения заболеваний пародонта занимает много времени, требует высокого уровня мотивации и мануальных навыков — как у врача, так и у пациента — и может вызвать повреждение тканей. Было бы неразумно полагать, что одни механические инструменты способны полностью удалить пародонтальные патогены со всех зараженных участков (Mombelli et al. 2000). Бактерии могут быть недоступны механическим инструментам на вогнутых поверхностях, в лакунах и дентинных канальцах, не говоря уже о проникновении в мягкие ткани. Существенная травма твердых тканей может возникнуть в результате повторных измерительных манипуляций в местах, не отвечающих на лечение, или в местах с рецидивирующим заболеванием. Кроме того, успешно обработанные участки могут быть реколонизированы патогенными микроорганизмами, сохраняющимися в не связанных с зубами областях.
Специфические особенности пародонтальной инфекции
Две специфические особенности пародонтальной инфекции имеют первостепенное значение в связи с использованием противомикробных препаратов. Во-первых, термин «инфекция» обычно относится к тканевой инвазии и размножению патогенных микроорганизмов в тканях. Уникальность связанных с биопленкой стоматологических заболеваний как инфекций, однако, связана с отсутствием инвазии массивных бактериальных тканей. Хотя есть подтверждение проникновения бактерий в высоко активных состояниях, таких как абсцессы пародонта и некротические заболевания пародонта (Listgarten 1965; Saglie et al. 1982a, b; Allenspach‐Petrzilka&Guggenheim 1983; Carranza et al. 1983), инвазия и размножение бактерий в тканях пародонта не считается необходимым условием для развития заболевания. Очевидно, что микроорганизмы, присутствующие в субгингивальных отложениях, могут вредить этим тканям и без их проникновения. Отсюда следует, что для того, чтобы быть эффективными, антимикробные препараты, используемые в контексте пародонтальной терапии, должны быть доступны в достаточно высокой концентрации не только внутри, но и снаружи пораженных тканей. В среде пародонтального кармана эти препараты могут быть ингибированы, инактивированы или разрушены большими массами присутствующих микроорганизмов.
Во-первых, терапевтические концентрации могут быть труднодостижимы, и устойчивость к антибиотикам должна возникать там, где проникновение препарата ограничено. Во-вторых, субгингивальная микробиота накапливается на поверхности корня, образуя прилипший слой налета, называемый «биопленка». Всесторонние обзоры подчеркивают важность формирования биопленки в этиологии многих инфекций и указывают на значения этого для терапии в более широкой перспективе (Socransky&Haffajee 2002; Costerton 2005; Costerton et al. 2005; Marsh 2005; Davey &Costerton 2006,). Стоматологические биопленки имеют большинство характеристик других известных в настоящее время биопленок, причем устойчивость к противомикробным препаратам имеет особое значение (Marsh 2004; Marsh et al. 2011). Пародонтальные патогены такие как Aggregatibacter actinomycetemcomitans (ранее известные как Actinobacillus actinomycetemcomitans)(Norskov‐Lauritsen&Kilian 2006) и Porphyromonas gingivalis демонстрируют более высокие уровни толерантности к нескольким антимикробным агентам при внедрении в биопленки, чем в виде планктонных клеток (Larsen 2002; Noiri et al. 2003;Eick et al. 2004; Takahashi et al. 2007). Кроме того, в биопленках устойчивые микроорганизмы с низкой вирулентностью могут защищать чувствительные к антибиотикам патогены (O’Connell et al. 2006). Механизмы, повышающие антимикробную резистентность микроорганизмов в биопленках, различаются у разных видов бактерий и зависят от состава и экологических условий в биопленке. К ним относятся защита внеклеточными полимерными веществами, приводящая к неспособности антимикробного агента проникать в биопленку, и принятие устойчивого физиологического состояния или фенотипа, связанного с многоклеточной природой сообщества биопленок. Биопленки играют важную роль в распространении устойчивости к антибиотикам. В густой бактериальной популяции происходит эффективная горизонтальная передача генов устойчивости и вирулентности. Признавая эти явления, существует общее мнение, что заболевания пародонта не следует лечить только антимикробными средствами (Herrera et al. 2008; Sanz&Teughels 2008). Всегда необходимо проводить тщательную механическую обработку для разрушения структурированных отложений, что приводит к значительному уменьшению микробной массы, которая может ингибировать или разрушать антимикробный агент.
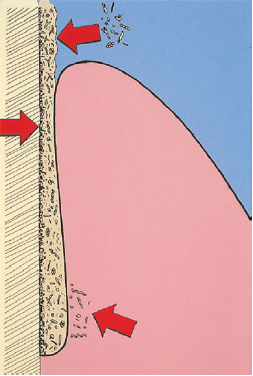
Особые условия применения при применении антибиотиков в пародонтологии: пародонтальный карман как открытая площадка подвергается реколонизации после лечения (стрелка сверху); поддесневые бактерии защищаются от антимикробных агентов в биопленке (средняя стрелка); антибиотик должен быть доступен в достаточно высокой концентрации не только в тканях пародонта, но и в поддесневой среде вне тканей пародонта
(нижняя стрелка).
Должна ли антимикробная терапия быть направлена на конкретные патогены?
Более пристальное изучение состава субгингивальной микробиоты показывает, что лечение пародонта направлено на разнообразную смесь различных бактерий (Kroes et al. 1999; Paster et al. 2001). Число различных видов и подвидов, время от времени идентифицируемых в образцах из биопленок полости рта человека, значительно превышает 100, но лишь относительно немногие демонстрируют характерную связь с заболеванием. Хотя считается, что большинство этих организмов наносят значительный вред тканям, только если они присутствуют в больших количествах в течение длительных периодов, некоторые виды могут оказывать негативное влияние, если присутствуют в относительно небольших количествах у восприимчивых людей. На основании их патогенности, продемонстрированной в экспериментах на животных, и идентификации факторов вирулентности, ограниченное число организмов было предложено в качестве специфических пародонтальных патогенов. A. Actinomycetemcomitans и P. gingivalis привлекли особое внимание, потому что продольные и ретроспективные исследования показали повышенный риск развития пародонтита на позитивных участках, а также результаты лечения были лучше, когда эти организмы больше не обнаруживались при последующем наблюдении (Haffajee et al. 1991; Grossi et al. 1994; Haffajee&Socransky 1994; Dahlen et al. 1996; Rams et al. 1996;Bragd et al. 1987; Wennstromet al. 1987; Carlos et al.1988; Chaves et al. 2000). A. Actinomycetem comitans демонстрирует широкое генетическое и фенотипическое разнообразие и неоднородно распределен по различным популяциям и когортам по всему миру (Kilian et al. 2006). В одном большом проспективном исследовании (Haubek et al. 2008) только одна субпопуляция A. Actinomycetem comitans, «JP2clone» (Tsai et al. 1984), показал свойства истинного возбудителя. В настоящее время ведутся дебаты об использовании микробиологических тестов для выявления таких организмов для оптимизации пародонтальной терапии. Как будет обсуждаться далее в разделе, посвященном системным антибиотикам, будут обсуждаться последние исследования, показывающие клинические преимущества методов лечения, предположительно нацеленных на такие организмы, даже в их отсутствие. Антибактериальные препараты узкого спектра, такие как Метронидазол, были предложены для пародонтальной терапии у пациентов, отрицательных по отношению к A. actinomycetemcomitans, на основании гипотезы о том, что полезные бактерии, устойчивые к Метронидазолу, могут подавлять возникновение анаэробных патогенов, таких как P. gingivalis. Эта теория не была доказана клиническими испытаниями. Учитывая большое разнообразие микробиота, ассоциированное со всеми формами пародонтита, и сложные синергетические и антагонистические взаимодействия между представителями этой флоры, концепция специфической идентификации и уничтожения определенного патогена может быть иллюзорной (Cioncaet al. 2010), хотя результаты предыдущих испытаний могут свидетельствовать об обратном (Pavicicet al. 1994). В большинстве испытаний, показывающих положительные эффекты противомикробных препаратов, ни агенты, ни субъекты фактически не были отобраны на основе микробиологического тестирования. Это не исключает возможности того, что в некоторых случаях могут присутствовать вирулентные организмы, устойчивые к тестируемому препарату.
Способы введения препаратов
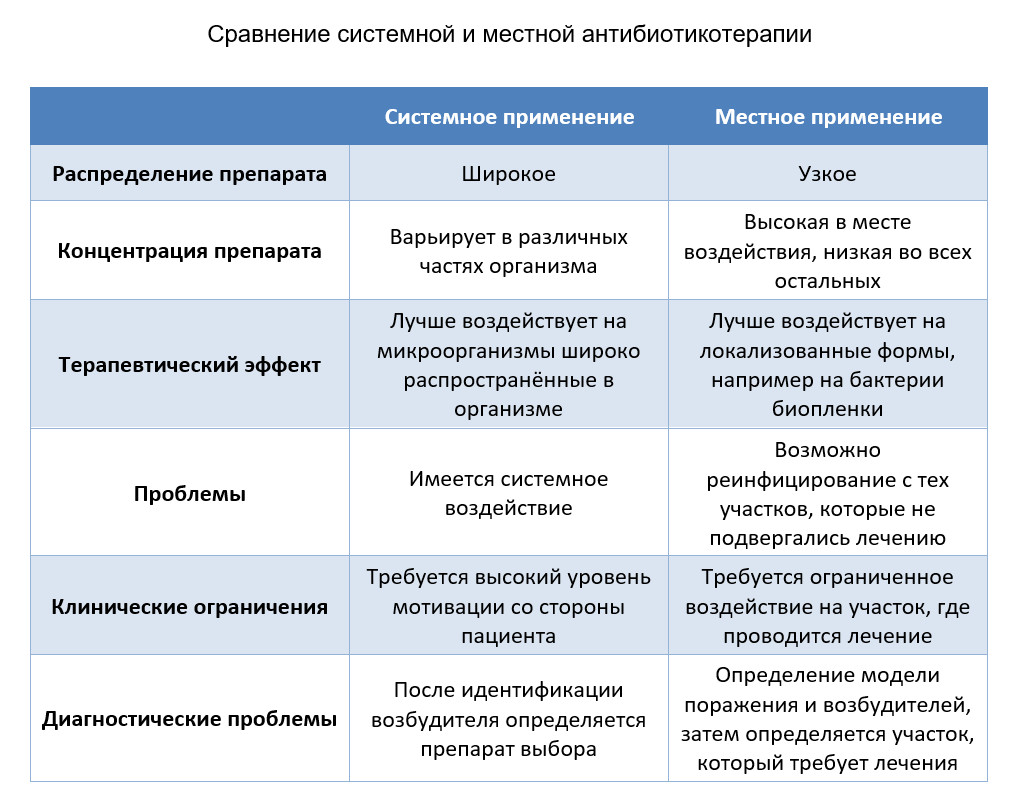
Наиболее распространенным путем доставки антибиотиков при лечении бактериальных инфекций является пероральный (per os). Назначение другими способами, а не через пищеварительный тракт (внутримышечно или внутривенно), обычно применяется при серьезных заболеваниях, при которых оральный путь оказался неэффективным. Некоторые местные инфекции можно лечить с помощью местных противомикробных препаратов, таких как глазные капли или мази. При лечении заболеваний пародонта противомикробные средства могут доставляться системным путем или путем непосредственного введения в пародонтальный карман. Каждый способ доставки имеет свои преимущества и недостатки (Таблица ниже). Местная терапия может позволить применение противомикробных препаратов на уровнях, которые не могут быть достигнуты системным путем, и могут быть подходящими для препаратов, например антисептиков, которые слишком токсичны для доставки системным путем. Эта форма применения представляется особенно перспективной, если целевые организмы обнаруживаются ограниченно в клинически видимых поражениях. Системное введение антибиотиков может быть предпочтительнее, если бактерии-мишени распространяются более широко. Исследования показали, что у некоторых пациентов пародонтальные бактерии могут распространяться по всей полости рта (Mombelli et al. 1991a, 1994), в том числе в местах, не связанных с зубами, таких как спинка языка или миндалины (Zambon et al. 1981; Muller et al.1993; Pavicic et al. 1994; Muller et al. 1995; van Winkelhoff et al. 1988). Недостатки системной антибактериальной терапии связаны с тем, что лекарство распространяется по всему организму, и лишь небольшая часть общей дозы фактически достигает субгингивальной микробиоты в пародонтальном кармане. Неблагоприятные лекарственные реакции вызывают большую обеспокоенность и чаще возникают, если лекарства распространяются по системному пути. Даже легкие формы нежелательных эффектов могут серьезно повлиять на соблюдение режима пациентом (Loescheet al. 1993). Местное введение не зависит от соблюдения пациентом режима лечения. Способы, предлагаемые для местного применения лекарств в пародонтальных карманах, варьируются от простого орошения или аппликации мазей и гелей, содержащих лекарственные средства, до сложных методов, включающих препараты для длительного высвобождения антибактериальных агентов. Чтобы быть эффективным, лекарственное средство должно достигать всей пораженной области, особенно основания кармана, и должно оставаться там с достаточно высокой концентрацией в течение определенного периода времени. При полоскании полости рта или наддесневом орошении это невозможно. Способы, предложенные для местного применения лекарств в пародонтальных карманах, варьируются от простого орошения или аппликации мазей и гелей, содержащих лекарственные средства, до сложных методов, включающих препараты для замедленного высвобождения антибактериальных агентов, которые, как ожидается, доставляют лекарственный препарат в более глубокие части дефекта пародонта (Pitcher et al. 1980; Eakle et al. 1986). Десневая жидкость (GCF) быстро вымывает препараты, попадающие в пародонтальные карманы при субгингивальном орошении. Основываясь на предполагаемом объеме кармана в 0,5 мл и скорости потока десневой жидкости 20 мкл / ч, Goodson (1989) подсчитал, что период полураспада не связанного препарата, введенного в карман, составляет около 1 минуты. Таким образом, даже высококонцентрированный, сильнодействующий препарат будет разводиться ниже минимальной ингибирующей концентрации (MIC) для микроорганизмов полости рта в течение нескольких минут. Если препарат может связываться с поверхностями и высвобождаться в активной форме, можно ожидать продолжительного времени антибактериальной активности. Такой эффект действительно был отмечен для концентраций хлоргексидина в слюне после полоскания полости рта хлоргексидином (Bonesvoll & Gjermo 1978). Хотя есть признаки того, что это может также происходить в определенной степени в пародонтальном кармане, например, после продолжительного субгингивального орошения тетрациклином (Tonettiet al.1990), существует вероятность создания резервуара с лекарственными препаратами значительного размера на небольшой площади, ограниченной поверхностью пародонтального кармана. Чтобы поддерживать высокую концентрацию в течение длительного периода, промывающее действие потока десневой жидкости должно противодействовать постоянному высвобождению лекарственного средства из более крупного источника. Учитывая небольшой объем пародонтального кармана и давление, оказываемое тонусом тканей пародонта на все, что введено, маловероятно, что это может быть достигнуто носителем, который не поддерживает свою физическую стабильность в течение некоторого времени и который не может быть защищен от преждевременного выведения. Гели, например, быстро исчезают после закапывания в пародонтальные карманы, если их вязкость не изменяется сразу после введения (Oostervaal et al. 1990; Stoltze 1995). Вязкие и / или биоразлагаемые препараты демонстрируют экспоненциальное снижение концентрации в десневой жидкости. Чтобы обеспечить постоянный контроль над высвобождением лекарственного средства, необходимо иметь матрицу, которая будет стабильной в течение более длительного периода времени, чем лекарственное действие. Контролируемое введение противомикробного средства в течение нескольких дней показано для тетрациклина, высвобождаемого из неразлагаемых монолитных этиленвинилацетатных волокон.
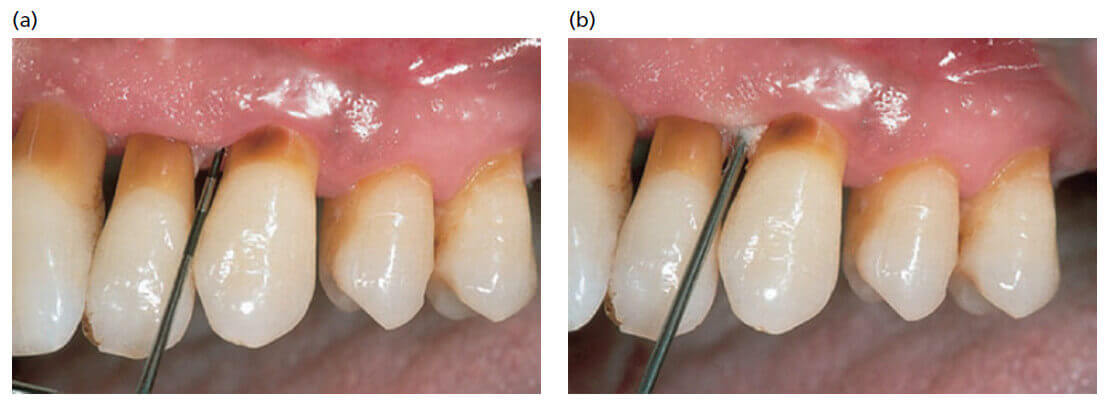
а) антимикробный гель наносится шприцем, помешенным в карман (а). Для удержания вещества в данном участке, вязкость носителя должна измениться немедленно. В противном случае большая часть вещества может быть быстро удалена из кармана (b).
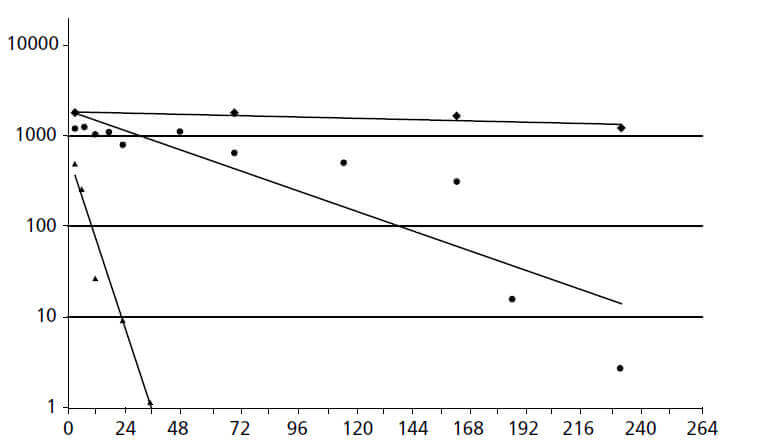
Средняя концентрация тетрациклина ( ♦ ) в десневой жидкости при использовании нитей тетрациклина (Tonetti et al.1990), доксициклина ( ●) при применения активного вещества в биоразлагаемом полимере (Stoller et al. 1998) и метронидазола (▲) после применение 25% геля (Stoltze 1992).
Системные антибиотики
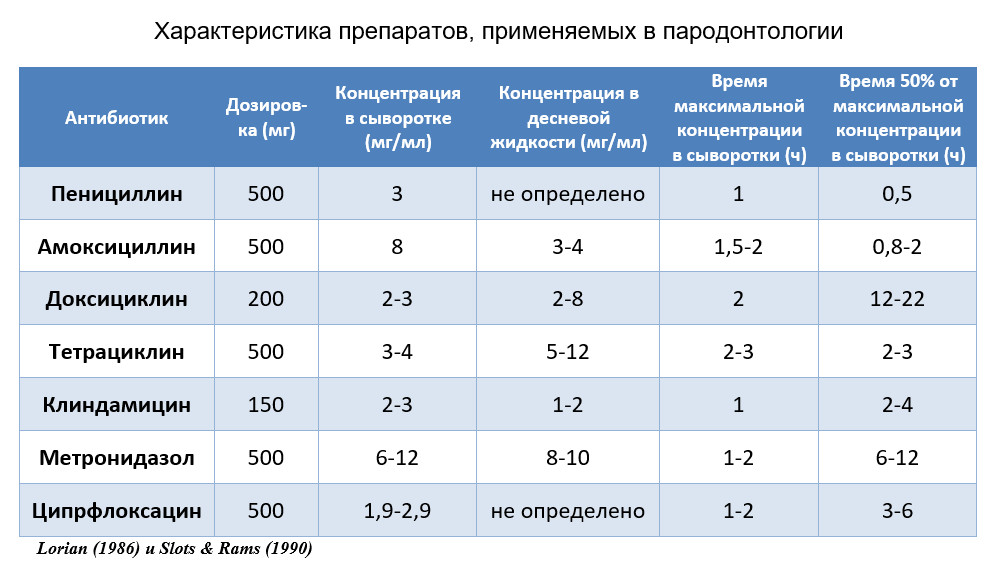
Только ограниченное количество противомикробных препаратов широкого спектра было тщательно протестировано для применения в пародонтальной терапии. Лекарственные средства, наиболее широко исследуемые для системного применения, включают тетрациклин, миноциклин и доксициклин, клиндамицин, ампициллин, амоксициллин (с клавулановой кислотой или без нее), макролиды, такие как азеритромицин, спирамицин, азитромицин и кларитромицин, а также нитроимидазольные соединения, метронидазол и орнидазол и некоторые их комбинации. Первыми антибиотиками, использовавшимися в пародонтальной терапии, были в основном системные пенициллины. Выбор изначально был основан исключительно на эмпирических данных. Пенициллины и цефалоспорины действуют путем ингибирования синтеза клеточной стенки. Они имеют узкий спектр действия и обладают бактерицидным действием. Среди пенициллинов амоксициллин был одобрен для лечения заболеваний пародонта из-за его значительной активности против нескольких пародонтальных патогенов, обнаруживаемых в десневой жидкости. Молекулярная структура пенициллинов включает β-лактамное кольцо, которое может расщепляться бактериальными ферментами. Некоторые бактериальные β-лактамазы имеют высокое сродство к клавулановой кислоте, молекуле β-лактама, не обладающей антимикробной активностью. Для ингибирования бактериальной активности β-лактамазы клавулановая кислота была успешно добавлена к амоксициллину. Эта комбинация (Аугментин) была протестирована для пародонтальной терапии в клинических исследованиях. Тетрациклин стал популярным в 1970-х годах благодаря своей антимикробной активности широкого спектра действия и низкой токсичности. Тетрациклины, клиндамицин и макролиды являются ингибиторами синтеза белка. Они имеют широкий спектр действия и являются бактериостатическими. В дополнение к их антимикробному эффекту тетрациклины способны ингибировать коллагеназу (Golub et al. 1985). Это торможение может помешать разрушению тканей при заболеваниях пародонта. Кроме того, они связываются с поверхностями зубов, откуда они могут постепенно высвобождаться (Stabholz et al. 1993). Нитроимидазолы были введены в пародонтологию в 1962 году, когда журнал Lancet опубликовал отчет пациентки, которая после недели лечения трихомонадного вагинита Метронидазолом заявила, что подверглась «двойному излечению». Вагинит был вылечен, и течение «острого маргинального гингивита», от которого она также страдала, было облегчено (Shinn 1962). Нитроимидазолы (метронидазол и орнидазол) и хинолоновые антибиотики (например, ципрофлоксацин) действуют путем ингибирования синтеза ДНК. Известно, что метронидазол превращается в короткоживущие промежуточные звенья после диффузии в анаэробный организм. Эти продукты реагируют с ДНК и другими бактериальными макромолекулами, что приводит к гибели клеток. Процесс включает реакции восстановления, характерные для строго анаэробных бактерий и простейших, но не для анаэробных или микроаэрофильных организмов. Таким образом, метронидазол особенно активен в отношении облигатной анаэробной микрофлоры полости рта, включая P. gingivalis и другие пигментобразующие грамотрицательные микроорганизмы, но не A.actinomycetemcomitans, причем последний является факультативным анаэробом. Концентрации после системного введения наиболее распространенных противомикробных препаратов, используемых при лечении заболеваний пародонта, перечислены в Таблице ниже. Восприимчивость A. actinomycetemcomitans к выбранным противомикробным препаратам in vitro представлена в Таблицах как и P. gingivalis. Данные, приведенные в этих таблицах, могут служить основой для выбора подходящего препарата. Однако важно помнить, что тесты in vitro не отражают истинные условия, обнаруженные в пародонтальных карманах. В частности, они не учитывают эффект биопленки. Кроме того, значения MIC зависят от технических условий, которые могут различаться в разных лабораториях. Как следствие, демонстрация восприимчивости in vitro не является доказательством того, что средство будет эффективным при лечении заболеваний пародонта.
Комбинированная антимикробная лекарственная терапия
Поскольку субгингивальная микробиота при пародонтите часто содержит несколько предполагаемых пародонтопатогенных патогенов с различной антимикробной восприимчивостью, может быть полезна комбинированная антимикробная лекарственная терапия с более широким спектром активности, чем один препарат. Совмещение в антимикробных спектрах различных препаратов может уменьшить возможное развитие бактериальной устойчивости. Некоторые комбинации лекарств оказывают синергетическое действие против микроорганизмов-мишеней, позволяя использовать более низкие дозы отдельных препаратов. Синергический эффект против A. actinomycetemcomitans был отмечен in vitro между метронидазолом и его гидроксиметаболитом (Jousimies-Someret al. 1988; Pavicicet al. 1991) и между этими двумя соединениями и амоксициллином (Pavicicet al. 1992). Некоторые лекарства, однако, могут взаимодействовать антагонистически. Например, бактериостатические агенты, такие как тетрациклины, которые подавляют деление клеток, могут уменьшить антимикробное действие бактерицидных антибиотиков, таких как β-лактамные препараты или метронидазол, которые действуют во время деления бактериальных клеток. Комбинированная лекарственная терапия также может привести к усилению побочных реакций.
Побочные реакции
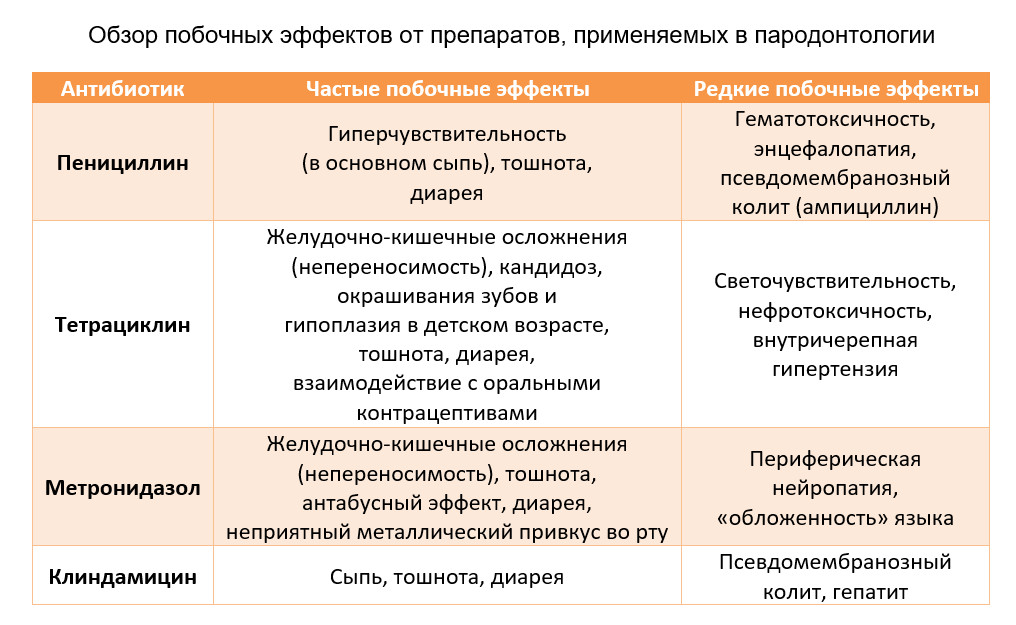
В таблице ниже перечислены распространенные побочные реакции на системную терапию антибиотиками (подробный обзор см. в Hersh & Moore 2008). Пенициллины являются одними из наименее токсичных антибиотиков. Реакции гиперчувствительности являются наиболее важными и наиболее распространенными побочными эффектами этих препаратов. Большинство реакций слабые и ограничиваются сыпью или поражением кожи в области головы или шеи. Более серьезные реакции могут вызвать отек и болезненность суставов. У пациентов с повышенной чувствительностью может развиться опасная для жизни анафилактическая реакция. Системное использование тетрациклинов может привести к боли в эпигастральной области, рвоте или диарее. Тетрациклины могут вызывать изменения в кишечной флоре и суперинфекции, связанные с небактериальными микроорганизмами (например, Candida albicans). Тетрациклины откладываются в кальцифицированных областях зубов и костей, где они вызывают окрашивания желтого цвета. Системное введение клиндамицина может сопровождаться желудочно-кишечными расстройствами, приводящими к диарее или спазмам, и может вызывать легкое раздражение кожи. Подавление нормальной кишечной флоры увеличивает риск колонизации Clostridium difficile, которая может вызвать тяжелую инфекцию толстой кишки (колит, связанный с антибиотиками). Хотя желудочно-кишечные проблемы, не связанные с C. difficile, также являются наиболее частым побочным эффектом системной терапии метронидазолом. Могут возникнуть тошнота, головная боль, анорексия и рвота. Симптомы могут быть более выраженными при употреблении алкоголя (эффект дисульфирама — Антабус), потому что имидазолы ингибируют фермент ацетальдегиддегидрогеназу на пути разложения этанола, что приводит к накоплению ацетальдегида. Поэтому следует избегать употребления алкоголя во время и сразу после терапии. Поскольку сообщалось о случаях постоянных периферических невропатий (онемение или парестезия), пациентам следует рекомендовать немедленно прекратить терапию при появлении таких симптомов. Существуют доказательства канцерогенной активности Метронидазола в исследованиях, включающих хроническое пероральное введение у мышей и крыс, но отсутствуют у других протестированных видов. Из-за неадекватных данных метронидазол не считается фактором риска развития рака у людей (Bendeskyet al. 2002). Ранее недиагностированный кандидоз может проявляться более выраженными симптомами во время антибактериальной терапии.
Системная антимикробная терапия в клинических исследованиях
Хотя клиническая эффективность не является абсолютным доказательством бактериологической эффективности (Marchant et al. 1992), доказательства использования системных антибиотиков должны поступать из клинических исследований на людях с пародонтитом. Было опубликовано большое количество отчетов, представляющих положительные эффекты в различных клинических ситуациях. Тем не менее, многие из них имеют высокий риск необъективных данных из-за низких показателей в критериях качества. Затруднения в интерпретации и сравнении исследований могут быть из-за неясного статуса пациента на исходном уровне (протокол лечения, активность заболевания, состав субгингивальной микробиоты), недостаточного или нестандартизированного ведения после терапии, коротких периодов наблюдения или отсутствия рандомизации и контроля. Исследования различаются не только в отношении проводимого лечения, но также в выборе субъектов, размера выборки, диапазона параметров исследования, переменных результатов, продолжительности и контролей, с которыми сравнивается процедура. В большинстве исследований системные антибиотики использовались в качестве дополнения к очищению и сглаживанию поверхностей корней (SRP). Как правило, эффект механической терапии плюс противомикробный препарат сравнивают с механическим лечением отдельно или плацебо. В исследованиях, оценивающих эффект антимикробной терапии у пациентов с рефрактерным пародонтитом или с рецидивирующим абсцессом, плацебо-контроль часто отсутствует по этическим причинам. Десять лет назад в контексте консенсусных конференций, в которых были опубликованы рекомендации по лечению пародонтита, впервые в двух систематических обзорах была оценена польза от системных антибиотиков. Herrera et al. (2002) включили 25 контролируемых клинических исследований продолжительностью не менее 6 месяцев, в которых системно здоровые субъекты с хроническими или агрессивными формами пародонтита лечились с добавлением системных антибиотиков или без них. В целом, пациенты, получавшие антибиотики, показали лучшие результаты, чем пациенты, не получавшие антибиотики. В глубоких карманах был обнаружен положительный эффект в плане изменения уровня клинического прикрепления (CAL) для комбинации амоксициллина и метронидазол, как и в случае со спирамицином в отношении изменения глубины зондирования (PPD). Результаты с одним метронидазолом показали тенденцию к статистической значимости. Haffajee et al. (2003) включили 27 контролируемых клинических испытаний с периодом наблюдения> 1 месяца и использованием среднего изменения CAL в качестве основного результата. В широком диапазоне терапевтических протоколов наиболее часто применяемым препаратом был метронидазол, один или в сочетании с амоксициллином. Во всех исследованиях группы антибиотиков показали значительно лучшие средние изменения CAL, чем контрольные группы. Исследования, позволяющие провести более подробный анализ, показали, что антибиотики оказывают наибольшее действие в областях с глубокими карманами (Lindheet al. 1983a, b; Palmer et al. 1996, 1998; Winkelet al.1999; Ramberget al. 2001; Winkelet al. 2001; Rooneyet al. 2002). Однако, используемые схемы приема антибиотиков для различных клинических или микробиологических состояний, не могут быть идентифицированы на основании имеющихся данных в это время. Определенные выводы также не могут быть сделаны относительно оптимальной дозировки и продолжительности антибиотикотерапии. С тех пор были проведены дальнейшие тщательно продуманные исследования, которые подтверждают пользу антибиотикотерапии и предоставляют дополнительную информацию. Двадцать три относительно недавних статьи, касающиеся 18 рандомизированных клинических исследований, подтверждают специфическое преимущество дополнения SRP амоксициллином и метронидазолом (Ehmke et al. 2003, 2005; Guerrero et al.2005; Mombelli et al. 2005; Giannopoulou et al. 2006;Xajigeorgiou et al. 2006; Guerrero et al. 2007; Kaner et al. 2007b; Moeintaghavi et al. 2007; Moreira &Feres‐Filho 2007; Akincibay et al. 2008; Johnson et al. 2008;Machtei&Younis 2008; Cionca et al. 2009; RibeiroEdel et al. 2009; Valenza et al. 2009; Cionca et al. 2010; Mestnik et al. 2010; Yek et al. 2010; Baltacioglu et al.2011; Heller et al. 2011; Silva et al. 2011; Varela et al.2011). Доступны результаты нескольких исследований, сравнивающих различные антимикробные схемы (Rooney et al.2002; Haffajee et al. 2007; Akincibay et al. 2008; Machtei&Younis 2008; Baltacioglu et al. 2011; Silva et al. 2011). Ни одно исследование не продемонстрировало лучших результатов, чем системное использование амоксициллина и метронидазола с другими протоколами при любом клинически или микробиологически определенном варианте заболевания пародонта. Но сравнение между комбинацией метронидазола и амоксициллина и приемом только метронидазола не показало значительных преимуществ для комбинации.
Длительность системной антибиотикотерапии
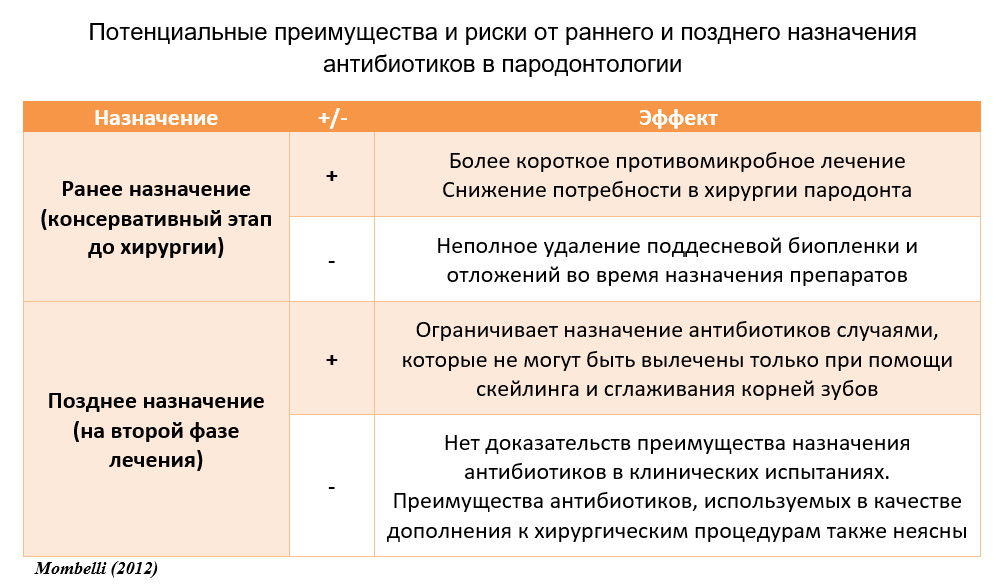
Оптимальные сроки приема антимикробного препарата являются предметом споров (Таблица ниже). В клинической практике пародонтальная терапия обычно проводится в два этапа. Сначала зубные отложения удаляются без отслоения лоскута. Через 3–6 месяцев результат повторно оценивается, и, если это будет сочтено необходимым, следует дальнейшая обработка поверхности корня, на этот раз в контексте местного хирургического вмешательства. Первое исследование, демонстрирующее снижение потребности в хирургической терапии у пациентов, которые на ранних этапах получали системный метронидазол в качестве дополнения к SRP (Loesche et al. 1992), а также более поздняя публикация, утверждающая положительный эффект через 5 лет после первоначальной антимикробной терапии (Loesche et al. 2002), встретила неодобрение со стороны видных представителей сообщества пародонтологов. Откладывание антибиотикотерапии до второй фазы хирургического лечения может быть обосновано двумя аргументами: (1) так как известно, что только процедура SRP способна самостоятельно устранить патологии пародонта (Heitz-Mayfield et al. 2002; van der Weijden & Timmerman 2002) эта стратегия может помочь ограничить назначение антибиотиков до минимума; (2) учитывая ограниченное действие антибиотиков на интактную биопленку (Sedlacek & Walker 2007) и известные ограничения нехирургической механической обработки (Rabbani et al. 1981; Buchanan & Robertson 1987), может потребоваться хирургическое вмешательство для обеспечения полного удаления субгингивальной биопленки и зубных отложений. Это рассуждение кажется логичным, однако данные специально разработанных контролируемых исследований не могут подтвердить эту рекомендацию. Вопреки этому мнению, в подавляющем большинстве исследований антибиотики тестировались как дополнение к нехирургическому лечению. Систематический обзор для оценки относительной пользы от назначения антибиотиков во время нехирургической или хирургической фазы терапии был неокончательным (Herrera et al.2008). Тем не менее, два исследования, не включенные в этот обзор, показали, что для субъектов с генерализованным агрессивным периодонтитом были достигнуты лучшие клинические результаты, если пациентам давали амоксициллин и метронидазол сразу после первоначальной процедуры SRP, а не после повторного лечения персистирующей патологии (Kaner et al. 2007b; Griffiths et al. др. 2011). Поскольку в большинстве случаев механическая пародонтальная терапия по практическим причинам не может быть проведена за один сеанс, необходимо решить, следует ли начинать дополнительную системную антимикробную терапию до, во время или после обработки. Сравнение результатов двух исследований, в одном из которых назначали метронидазол или плацебо после первого сеанса обработки, а в другом — после последнего сеанса обработки, показало значительный эффект протокола, предполагающего медикаментозное лечение после механической обработки (Loesche & Giordano 1994). На основании этих результатов и того факта, что нетронутая биопленка защищает бактерии от антибиотиков, рекомендуется начинать антимикробную терапию сразу же после механической терапии (то есть вечером после последнего сеанса нехирургического лечения). Антибиотики назначались по данному протоколу в нескольких исследованиях с хорошими результатами. В некоторых случаях механическая терапия первоначально проводится без противомикробных препаратов и оценивается через соответствующий промежуток времени. Если считается необходимым вводить антибиотики при повторной оценке, перед назначением антибактериальных препаратов необходимо заново провести механическую обработку, чтобы максимально уменьшить бактериальную массу и разрушить новообразованную биопленку, даже если нет поддесневых зубных отложений. Это может быть достигнуто во время хирургического вмешательства, но также показано, даже если повторная механическая терапия не представляется необходимой с клинической точки зрения.
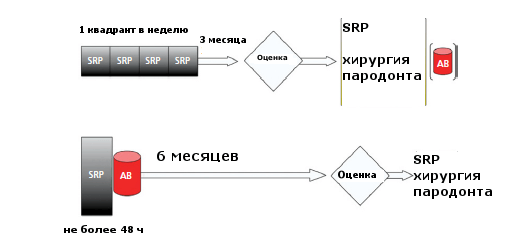
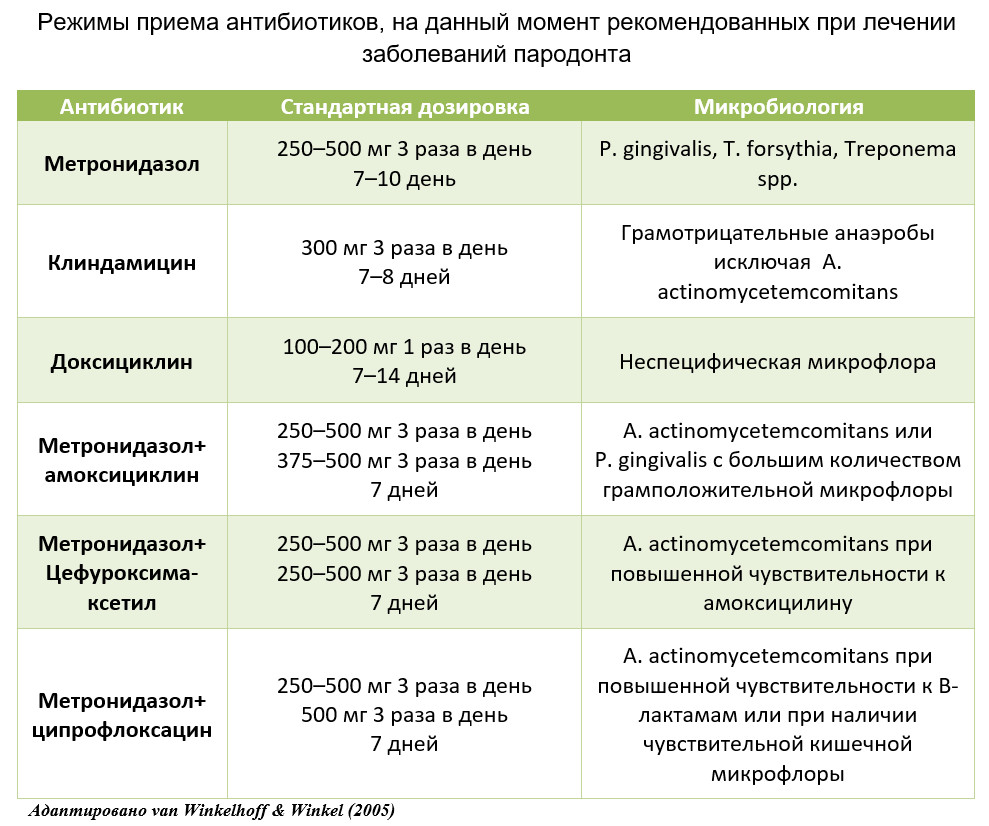
Традиционный (верхний) и альтернативный (нижний) подходы к пародонтальной терапии. (AB-антибиотикотерапия; SRP-скейлинг+сглаживание корней)(Адаптированная схема Mombelli et al. 2011 ).
Отбор пациентов для системной антибиотикотерапии с максимальной вероятностью успеха
Чтобы ограничить развитие микробной резистентности к антибиотикам в целом и избежать риска нежелательных системных эффектов антибиотиков для человека, подвергаемого лечению, целесообразно предусмотреть предупредительное, ограничительное отношение к применению антибиотиков. Рекомендовано рассматривать системные антибиотики в качестве дополнения к SRP для пациентов с глубокими карманами, агрессивными формами заболевания, «активными» участками или специфическими микробиологическими профилями (Lindhe & Palmer 2002). Тем не менее, основываясь на данных тщательно сформированных рандомизированных клинических исследований и, за исключением пациентов с известными медицинскими противопоказаниями (например, подтвержденной гиперчувствительностью), трудно определить четкие критерии исключения для антибиотикотерапии. Следующие критерии будут рассмотрены более подробно: тяжесть заболевания, соблюдение пациентом режима, диагностика как агрессивного, так и хронического пародонтита, микробиологический профиль и риск неблагоприятных эффектов.
Тяжесть заболевания
В нескольких из упомянутых выше исследований было отмечено, что при наличии глубоких карманов эффект антибиотиков выше, чем в менее глубоких. Хотя в некоторых случаях лечение антибиотиками снижало глубину зондирования в умеренно глубоких карманах более, чем при отсутствии антибиотиков, одна только процедура SRP способна предсказуемо устранить значительное количество патологий (Heitz-Mayfield et al. 2002; van der Weijden & Timmerman 2002). Таким образом, рекомендуется начинать лечение пародонтита легкой и средней степени тяжести без хирургического вмешательства и антибиотиков. Некоторые исследования показали определенную пользу антибиотиков, даже когда они назначаются без тщательной субгингивальной обработки (Berglundhet al. 1998; Lopez & Gamonal1998; Lopez et al. 2000, 2006). Тем не менее не следует назначать системные антибиотики для вместо полной механической обработки. Кроме того, для благоприятного клинического результата и долгосрочной стабильности контролирование зубных отложений пациентом имеет первостепенное значение, независимо от того, были ли получены кратковременные результаты лечения с применением или без применения антибиотиков (Kornmanet al. 1994). Что касается диагностики, можно сказать, что не все методы лечения одинаково хорошо работают при всех формах заболеваний пародонта. Было отмечено, что после лечения амоксициллином и метронидазолом у пациентов наблюдается чрезвычайно низкая частота нагноения (Rooneyet al. 2002; Cioncaet al. 2009), что указывает на потенциальные показания для этой схемы, особенно в случаях с активными гнойными поражениями. Проблема с рекомендациями для конкретных диагнозов заключается в отсутствии доказательств в специально разработанных исследованиях, оценивающих результаты конкретной терапии у пациентов с различными диагнозами. Однако из похожих исследований ясно (например, Guerrero et al. 2005; Cioncaet al. 2009), что наиболее проверенная схема сочетания амоксициллина и метронидазола оказывает благоприятное действие у пациентов с хроническим и агрессивным периодонтитом. В таблице перечислены дополнительные системные антибиотикотерапии, рекомендуемые в настоящее время для лечения заболеваний пародонта. Один метронидазол оказался эффективным против P. gingivalis, Tannerella forsythia, спирохет и других строго анаэробных грамотрицательных бактерий. Было показано, что клиндамицин и тетрациклины действуют на широкий спектр пародонтальныйх бактерий. Терапия с использованием одного антибиотика в качестве дополнения к механической обработке может незначительно изменить состав субгингивальной микробиоты, но некоторые пародонтальные микроорганизмы не могут быть предсказуемо элиминированы. Комбинация амоксициллина и метронидазола обладает доказанной способностью подавлять A. actinomycetemcomitans при поражениях пародонта и других участков полости рта (vanWinkelhoff et al. 1989; Goene et al. 1990; Pavicic et al.1992; van Winkelhoff et al. 1992; Pavicic et al. 1994; Berglundh et и др. 1998; Flemmig et и др. 1998b; Mombelli et и др. 2002; Dannewitz et и др. 2007), и поэтому является препаратом выбора многих клиницистов, особенно для лечения прогрессирующего пародонтита, ассоциированного с A. actinomycetemcomitans. Для пациентов с непереносимостью амоксициллина был предложен метронидазол в сочетании с цефуроксим аксетилом или ципрофлоксацином (Rams et al. 1992; van Winkelhoff & Winkel 2005). Проблема с вынесением обязательной рекомендации о том, что микробиологическое тестирование должно проводиться до назначения системных антибиотиков, заключается в отсутствии однозначных доказательств того, что пациенты, у которых тестирование на определенные бактерии не дает положительных результатов, не получают пользы от лечения. В рандомизированных клинических исследованиях (Flemmig et al. 1998a; Winkel et al. 2001; Rooney et al. 2002; Cionca et al.2010) специфическая клиническая польза амоксициллина и метронидазола только у субъектов, положительных по A. actinomycetemcomitans, не может быть продемонстрирована. Напротив, большинство участников этих испытаний были A. actinomycetemcomitans отрицательными; следовательно, преимущество амоксициллина и метронидазол в значительной степени обусловлено лечением пациентов, отрицательных по отношению к A. actinomycetemcomitans. В недавнем исследовании было установлено, что при микробиологическом тестировании на наличие или отсутствие A. actinomycetemcomitans до начала терапии выявляются пациенты с пародонтитом от средней до тяжелой степени, которые особенно выигрывают от применения амоксициллина и метронидазола, если он назначается в сочетании с полной механической обработки в течение 48 часов. Что касается наличия карманов, которые, как считается, нуждаются в дальнейшей терапии в соответствии с обычной практикой (карманы глубже 4 мм, кровоточивость при повторном зондировании), ответ был отрицательным (Mombelli et al. 2013). Это наблюдение не может быть распространено на все противомикробные протоколы, особенно если используются препараты с узким спектром действия. Результаты могли бы быть другими, если был назначен только метронидазол. Утверждалось, что введение антибиотиков пациентам с отрицательным результатом P. gingivalis может быть чрезмерным лечением (van Winkelhoff & Winkel 2009). Авторы, поднявшие эту проблему, ссылались на свое собственное исследование 49 пациентов с хроническим пародонтитом, которым было проведено механическое удаление зубных отложений и назначен амоксициллин с метронидазолом или плацебо (Winkel et al. 2001). В этом исследовании P. gingivalis-положительные пациенты показали значительно лучшие результаты при лечении антибиотиками, чем при лечении плацебо. Тем не менее, более внимательное изучение их данных показывает, что процент карманов> 4 мм уменьшился в сходной степени также у субъектов с отрицательными результатами P. gingivalis, получавших антибиотики. По крайней мере, три других исследования (Flemmig et al.1998a; Rooney et al. 2002; Cionca et al. 2010) ясно продемонстрировали преимущества дополнения механической терапии амоксициллином и метронидазолом в случаях, отрицательных по P. gingivalis. Риск побочных эффектов следует учитывать особенно при назначении более одного антибиотика. Хотя сообщаемые побочные эффекты, как правило, незначительны, серьезные проблемы не могут быть сброшены со счетов. Для сравнения: частоту и последствия побочных эффектов антибиотиков необходимо сопоставить с потенциальными последствиями для здоровья, вызванными ненадлежащим лечением инфекции пародонта, а также с неудобствами, дискомфортом и финансовыми последствиями дальнейшей терапии. Традиционный подход иногда расширяет лечение на несколько месяцев, в то время как механическая обработка и амоксициллин плюс метронидазол могут элиминировать инфекцию в течение нескольких дней (Mombelli et al. 2011). Было показано, что механическая обработка и амоксициллин плюс метронидазол снижают клинические признаки воспаления и воспалительных биомаркеров в десневой жидкости более глубоко, чем только механическая обработка (Giannopoulouet al. 2006). Хотя это и не подтверждено клиническим исследованием, с общей точки зрения в отношении здоровья кажется предпочтительным, чтобы пациенты как можно раньше получали пользу от положительных системных эффектов успешной пародонтальной терапии (Noack et al. 2001; D’Aiuto et al. 2004, 2005). Если число пациентов, жалующихся на желудочно-кишечные проблемы, особенно диарею, было действительно выше в тесте, чем в группе плацебо одного клинического испытания (Cioncaet al. 2009), также стоит учитывать, что потеря зуба и продолжающееся воспаление, несмотря на терапию, не были отмечены в контрольной группе.
Минимизация риска развития устойчивости к антимикробным препаратам
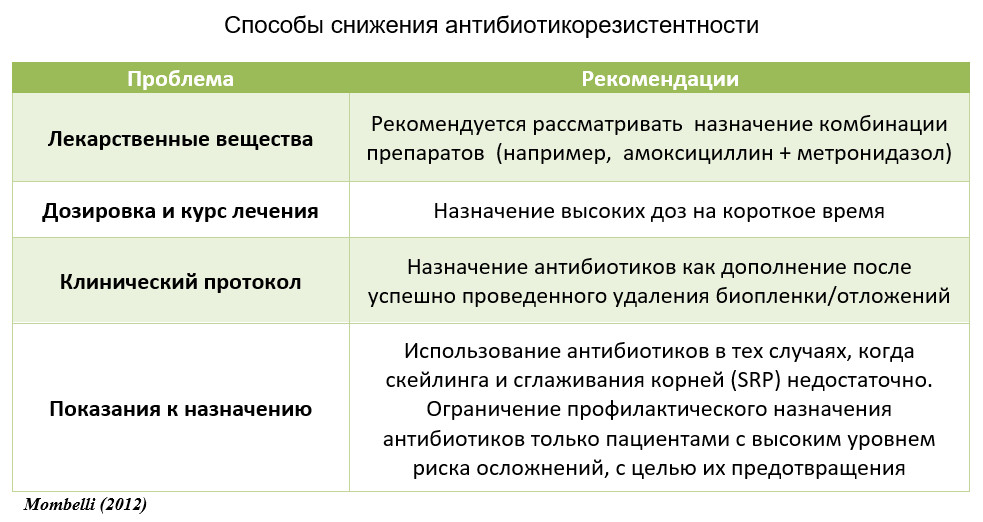
Антибиотикотерапия несет в себе риск развития бактериальной устойчивости к антибиотикам. Поскольку заболевания пародонта не опасны для жизни и могут быть вылечены в основном без антибиотиков, к этой проблеме следует отнестись серьезно. Однако влияние различных протоколов лечения на развитие устойчивости к бактериальным антибиотикам, к сожалению, до сих пор не оценивалось в адекватно спланированных клинических испытаниях. Микробиологические исследования должны быть сосредоточены не только на действии антибиотиков против микроорганизмов, непосредственно участвующих в заболеваниях пародонта, то есть преимущественно грамотрицательного комплекса субгингивальной микробиоты, но и на организмах, которые имеют отношение к другим причинам, таким как стафилококки или энтерококки. Развитие резистентности, вызывающее наибольшую обеспокоенность в настоящее время: MRSA (Staphylococcus aureusstrains, устойчивые к метициллину и, как правило, также к множеству других антибиотиков), VRE (Enterococcus видов, резистентных к ванкомицину), PRSP (Streptococcus pneumoniaestrains, очень устойчивые к пенициллину), и ESBL (Escherichia coli и др. Gracher). к антибиотикам, таким как пенициллины, цефалоспорины и монобактамы). Предлагаемые стратегии по снижению риска бактериальной устойчивости к противомикробным препаратам перечислены в таблице 43-8. Можно ожидать, что в смешанной субгингивальной микробиоте некоторые микроорганизмы будут устойчивы к любым отдельным антимикробным препаратам (Ardila et al. 2010). Поэтому для преодоления устойчивости к антибиотикам комбинированная терапия может быть полезной. Было признано, что доза и продолжительность антимикробной терапии являются важными параметрами для развития резистентности. Субоптимальная доза антибиотиков, вызванная либо неадекватным назначением, либо несоблюдением режима пациентом, способствует появлению устойчивых к антибиотикам бактериальных клонов. Клинические исследования в других областях показывают, что предпочтительно назначать антибиотики в высоких дозах в течение короткого времени. Например, рандомизированное исследование, проведенное в поликлинике с участием 795 детей, получающих рецепты на антибиотики для лечения инфекций верхних дыхательных путей, продемонстрировало преимущество короткого курса лечения высокими дозами антибиотиков для минимизации влияния применения антибиотиков на распространение лекарственно-устойчивых пневмококков (Schrag et al. 2001). Классическая пероральная доза метронидазола во многих старых исследованиях составляла 250 мг в день на 10–14 дней. Эта дозировка может быть недостаточной для субъектов с большой массой тела. Сегодня человеку весом 75–80 кг рекомендуется принимать 500 мг метронидазола в течение 7 дней. Как обсуждалось выше, связанные с биопленкой инфекции устойчивы к антимикробной терапии, если только биопленка не разрушена механически. Поэтому повторяется, что любой антимикробной терапии должна предшествовать механическая обработка. Чтобы ограничить их чрезмерное использование, рекомендуется также избегать применения антибиотиков всякий раз, когда есть достаточные свидетельства того, что только нехирургическая механическая обработка может решить проблему, как в случае пародонтита легкой и средней степени тяжести (van derWeijden & Timmerman 2002). И последнее, но не менее важное: профилактическое использование антибиотиков должно быть ограничено у пациентов с высоким риском в качестве профилактики тяжелых осложнений (Duval et al. 2006; Esposito et al. 2008; Nishimura et al. 2008; Berbariet al. 2010).
Продолжение статьи «Антибиотики в пародонтологии. Часть 2. Местная антибиотикотерапия».
Перевод материала «Antibiotics in Periodontal Therapy» Andrea Mombelli и David Herrera
1. Department of Periodontology, School of Dental Medicine, University of Geneva, Geneva, Switzerland
2. Faculty of Odontology, University of Complutense, Madrid, Spain
выполнен автором проекта «Современная пародонтология» Екатериной Чирковой. Все ссылки на литературные источники в оригинале статьи.
