Продолжение статьи «Антибиотики в пародонтологии. Часть 1. Общие принципы и системная антибиотикотерапия».
Были разработаны различные методы введения противомикробных препаратов в пародонтальные карманы, которые подвергались многочисленным исследованиям. Недостатки полоскания, ирригации и аналогичных форм использования лекарств — быстрое выведение, приводящее к неадекватному воздействию на субгингивальные бактерии и отсутствию значительных клинических эффектов — уже неоднократно обсуждались. В этом разделе будут рассмотрены клинически протестированные системы введения лекарств, которые отвечают, по крайней мере, основным фармакокинетическим требованиям длительного высвобождения лекарств.
Антибиотики: местная терапия в клинических испытаниях
Многое из того, что было сказано о трудностях в интерпретации исследований, посвященных системному применению антибиотиков, относится к исследованиям, проводимым с использованием местных препаратов. Опять же, сравнения сложны, потому что исследования варьируются в зависимости от размера выборки, выбора субъектов, диапазона параметров, контроля, продолжительности и совокупности только одной формы локальной доставки лекарств. Большинство данных о терапевтическом эффекте средств локального введения получены в исследованиях с участием пациентов с ранее нелеченным хроническим («взрослым») периодонтитом. Наилучшие данные получены в рандомизированных клинических исследованиях, в которых местные противомикробные препараты вводились в качестве дополнения к нехирургическому механическому лечению, и где контрольная группа получала только нехирургическое механическое лечение или плацебо. Лишь в нескольких исследованиях было рассмотрено использование местного введения лекарств при периодических или постоянных поражениях пародонта, потенциально наиболее предпочтительной области для их применения. Некоторые протоколы сравнивают местное введение лекарств с отрицательным контролем, таким как применение только носителя без лекарства. Эти исследования показывают чистый эффект препарата, но они демонстрируют преимущество по сравнению с наиболее очевидной альтернативой – нехиргическим механическим лечением — и остается вопрос о том, какую ценность имеет процедура в дополнение к механическому лечению. Если исследование не может продемонстрировать существенную разницу между местным введением лекарств и нехирургическим механическим лечением, это не является автоматическим доказательством эквивалентности двух видов лечения (проверка эквивалентности требует статистической проверки достоверности данных с учетом размера выборки исследования).
Препараты, исследованные для местного применения, включают тетрациклин, миноциклин, доксициклин, метронидазол, азитромицин и хлоргексидин. Средства вводились с использованием следующих носителей: лаки (хлоргексидин), гели (доксициклин, метронидазол, миноциклин, азитромицин), не рассасывающиеся полимерные волокна (тетрациклин), желатиновые чипы (хлоргексидин), мази (тетрациклин) и рассасывающиеся полимерные микросферы (миноциклин). К сожалению, некоторые из коммерческих составов, которые были надлежащим образом испытаны в клинических испытаниях, в настоящее время недоступны в некоторых регионах мира или полностью исчезли, в то время как другие продукты без доказанной клинической эффективности продолжают вводиться и используются на эмпирической основе. Поскольку большинство исследований проводилось на пациентах с хроническим пародонтитом, приведенные ниже доказательства не будут включать исследования ювенильного пародонтита (Yilmaz et al. 1996) или агрессивного периодонтита (Duarte et al. 2009).
Обзор различных препаратов
Миноциклиновая мазь и микросферы
Субгингивальное введение миноциклина было исследовано в виде 2% мази (Dentomycin; Cyanamid, Lederle Division, Wayne, NJ, USA) или как порошок, состоящий из рассасывающихся полимерных микросфер (Arestin; OraPharma, Warminster, PA, USA) , по крайней мере, в 13 рандомизированных клинических исследованиях (Nakagawa et al. 1991; van Steenberghe et al. 1993; Jones et al.1994; Graca et al. 1997; Jarrold et al. 1997; Kinane&Radvar 1999; Williams et al. 2001; Henderson et al.2002; Meinberg et al. 2002; Van Dyke et al. 2002; Goodson et al. 2007; Bland et al. 2010). Различия в изменениях средней глубины зондирования были статистически значимыми между тестовой и контрольной группами в пяти исследованиях. Контрольные группы продемонстрировали среднее изменение в диапазоне от 0,4 до 1,9 мм, а контрольные группы — от 0,9 до 2,6 мм. В четырех исследованиях сообщалось о статистически значимой разнице между группами в изменениях потери клинического прикрепления. Величина различий между группами колебалась от 0 до 1,6 мм в контрольной и от 0,8 до 1,9 мм в тестовой группах. В трех исследованиях сообщалось о значительных различиях между группами в отношении кровоточивости при зондировании (BoP), причем снижение составляло от 5% до 46% в контрольной и от 4% до 87% в тестовой группах. По сравнению с одной только нехиругической механической терапией результаты различных исследований были последовательно в пользу механической терапии с миноциклином в отношении глубины зондирования, но не для потери клинического прикрепления и кровоточивости при зондировании.
Доксициклин гидрохлорид в биоразлагаемом полимере
Система смешивания с двумя шприцами для контролируемого выделения доксициклина (Atridox; Block Drug, JerseyCity, NJ, USA) была коммерчески доступной в течение нескольких лет. Один шприц содержит основу — текучий биоабсорбируемый поли (dl-лактид), растворенный в N-метил-2-пирролидоне, а другой – порошок доксициклин гидрохлорида. По крайней мере семь рандомизированных клинических испытаний подтвердили эту формулировку (Wennstrom et al. 2001; Eickholz et al. 2002; Akalin et al. 2004; Agan et al. 2006; Machion et al. 2006; Bogren et al. 2008; Gupta et al. 2008). Различия в изменениях потери клинического прикрепления были статистически значимыми между тестовой и контрольной группами в трех из этих семи испытаний. Контрольные группы продемонстрировали средние изменения в пределах от 1,1 до 3,1 мм, а контрольные группы — от 1,2 до 4,0 мм. Три исследования сообщают о статистически значимых межгрупповых различиях для изменений потери клинического прикрепления. Величина различий между группами варьировала от 0,5 до 1,6 мм в контрольной и от 0,7 до 3,2 мм в тестовой группах. В пяти работах сообщалось об изменениях кровоточивости при зондировании, причем в контрольной группе снижение составило от 8% до 56%, а в тестируемых группах — от 13% до 64%, но между группами нет существенных различий. Краткосрочные данные для глубины зондирования и потери клинического прикрепления соответственно благоприятствовали механической терапии с доксициклином по сравнению с одной только механической терапией в различных исследованиях. Никаких четких тенденций не наблюдалось для уровней кровоточивости при зондировании и наличии бляшек. В одном исследовании, в котором участвовало 105 пациентов в трех центрах (Wennstromet al. 2001), эффект Атридокса, примененного после обезболивания не более чем через 45 минут, сравнивали с 4 часами тщательной нехирургической механической терапии у пациентов с умеренно выраженным хроническим пародонтитом. Интересно отметить, что клинические параметры показали лучший результат при фармакомеханическом лечении через 3 месяца, хотя было потрачено значительно меньше времени, чем для обычной механической терапии.
Гель метронидазола
Диализные трубки, акриловые полоски и полоски полигидроксимасляной кислоты были испытаны в качестве твердых носителей для введения метронидазола. Наиболее широко используемым устройством для применения метронидазола является гель, состоящий из полутвердой суспензии 25% метронидазолебензоата в смеси глицерилмоноолеата и кунжутного масла (Elyzol Dental Gel; Dumex, Copenhagen,Denmark). Гель наносится с помощью шприца в карман, и его вязкость увеличивается после введения. Семь рандомизированных клинических испытаний оценивали эффекты этой формулы как дополнение к безоперационной механической терапии (Noyan et al. 1997;Lie et al. 1998; Kinane&Radvar 1999; Palmer et al.1999; Riep et al. 1999; Griffiths et al. 2000; Stelzel&Flores‐de‐Jacoby 2000). Изменения глубины зондирования были зарегистрированы во всех семи исследованиях, причем средние различия между группами варьировались от 0,7 до 1,7 мм в контрольных группах и от 0,9 до 2,1 мм в тестовых группах. Однако различия между группами были значительными в конце периода наблюдения только в двух исследованиях. Что касается изменений потери клинического прикрепления, различия между группами варьировались от 0,4 до 0,9 мм в контрольной и от <0,1 до 0,8 мм в тестовых группах, а различия между группами были статистически значимыми в трех исследованиях. Кровоточивость при зондировании была зарегистрирован в шести исследованиях, с изменениями от 6% до 48% и от 11% до 59% в контрольной и тестовой группах, соответственно, со статистически значимыми различиями между группами только в одном исследовании. Результаты различных исследований были объединены, консервативня механическя терапия с метронидазолом выявлена предпочтительной по отношению к механической терапии с точки зрения глубины зондирования и кровоточивости при зондировании, но не с точки зрения потери клинического прикрепления.
Тетрациклин в нерезорбируемом пластиковом сополимере
Такие устройства, как диализные трубки, акриловые полоски, коллаген или полоски полигидроксимасляной кислоты были протестированы для введения тетрациклина в нескольких исследованиях. Полутвердые вязкие среды включают белый вазелин и гели полоксамер и карбопол . Наиболее испытанным устройством, высвобождающим тетрациклин, является пародонтальное волокно Actisite (ALZA, Palo Alto, CA, USA). Этот недоступный в настоящее время продукт состоит из монолитной нити из биологически инертного, не рассасывающегося пластического сополимера (этилена и винилацетата), содержащего 25% порошка тетрациклина-HCl. Волокно вводится в пародонтальный карман, закрепляется тонким слоем цианоакрилатного клея и оставляется на месте на 7–12 дней (Goodson et al. 1983, 1991). Непрерывная доставка тетрациклина поддерживает локальную концентрацию активного лекарственного средства, превышающую 1000 мг / л в течение этого периода (см. Изображение 43-3). По крайней мере девять рандомизированных клинических испытаний оценивали эффект тетрациклина в этом носителе (Minabe et al. 1991; Jeong et al. 1994; Newman et al. 1994; Drisko et al. 1995;Tonetti et al. 1998; Wong et al. 1998; Kinane&Radvar1999; Yalcin et al. 1999; Aimetti et al. 2004). Изменения глубины пародонтального зондирования были рассчитаны во всех исследованиях, при этом уменьшения глубины составили 0,4–1,2 мм и 1,3–2,6 мм в контрольной и тестовой группах соответственно, в трех исследованиях обнаружены статистически значимые различия между группами. Во всех исследованиях также сообщалось об изменениях потери клинического прикрепления, причем различия между группами варьировались от 0,1 до 0,7 мм и от 0,3 до 2,3 см в контрольной и тестовой группах соответственно. Различия между группами были статистически значимыми в одном из этих исследований. Изменения в кровоточивости при зондировании варьировались от 5% до 42% в контрольных группах и от 4% до 79% в тестовых группах, причем существенные различия были обнаружены в пяти исследованиях. Результаты различных исследований были объединены, консервативная механическая терапия с тетрациклиновыми волокнами выявлена предпотительной по отношению к только механической терапии с точки зрения глубины зондирования, потери клинического прикрепления и кровоточивости при зондировании.
Азитромицин в геле
Только в одном исследовании были представлены данные о дополнительном местном влиянии азитромицина при нехирургической механической обработке (Pradeep et al.2008). Различия в снижении глубины зондирования были статистически значимыми, прирост потери клинического прикрепления был значительно выше в тесте, чем в контрольной группе через 3 месяца. Кровоточивость при зондировании не оценивалась.
Препараты хлоргексидина
Было предпринято несколько попыток разработать устройства для локального субгингивального введения не только антибиотиков, но и антисептиков. Были оценены различные продукты, содержащие хлоргексидин, включая желатиновые чипы, лаки и ксантангель. Периочип (Perio Products, Jerusalem, Israel), разлагаемый желатиновый чип, содержащий 2,5 мг хлоргексидина, был тщательно протестирован по меньшей мере в 11 исследованиях (Soskolne et al. 1997; Jeffcoat et al. 1998, 2000; Heasman et al. 2001; Azmak et al. 2002; Grisi et al.2002; Mizrak et al. 2006; Carvalho et al. 2007; Kasaj et al. 2007; Paolantonio et al. 2008; Sakellari et al. 2010). Во всех исследованиях оценивали глубину зондирования. Улучшения варьировались от 0,3 до 2,3 мм в контрольной группе и от 0,8 до 3,8 мм в тестовой группах. Различия между группами были статистически значимыми только в шести исследованиях. Во всех 11 исследованиях оценивали потерю клинического прикрепления. Изменения варьировались от -0,4 до 1,6 мм в контроле и от -0,9 до +2,8 мм в тестовых группах и значительно различались между группами в шести исследованиях. Изменения кровоточивости при зондировании варьировали от 33% до 64% в контроле и от 22% до 63% в тестовых группах, при этом различия между группами достигли уровня статистической значимости в двух исследованиях. Результаты различных исследований были неоднородны с точки зрения глубины зондирования и потери клинического прикрепления, и только долгосрочные исследования и модели сплит-исследования обеспечили четкие различия между тестовой и контрольной группами. Хлоргексидиновый лак был испытан одной исследовательской группой в четырех различных исследованиях (Cosyn et al.2005, 2006a, b, 2007). Изменения глубины зондирования варьировались от 0,7 до 1,2 мм в контрольных группах и от 1,1 до 2,0 мм в испытуемых группах, а различия между группами были статистически значимыми в двух исследованиях. Для потери клинического прикрепления были зарегистрированы незначительные изменения без существенных различий между группами. Кровоточивость при зондировании снизилась на 27–50% в контрольной и на 34–47% в контрольных группах, без существенных различий между группами. Результаты этих исследований, проведенных одной и той же группой, неизменно благоприятствовали тестовой группе с точки зрения глубины зондирования, потери клинического прикрепления и кровоточивости при зондировании. Для местного применения противомикробных препаратов был предложен гель на основе ксантана, содержащий комбинацию 0,5% диглюконата хлоргексидина и 1% дигидрохлорида хлоргексидина (ChloSiteR; Casalecchio diReno, BO, Italy). Этот продукт был протестирован как минимум в двух исследованиях (Gupta et al. 2008; Paolantonio et al.2009). Изменения глубины зондирования, наблюдаемые в тестовой группе (диапазон 1,4–2,0 мм), были значительно лучше, чем в контрольной группе (диапазон 0,5–0,9 мм). Изменения потери клинического прикрепления в диапазоне от 2,4 до 2,8 мм в тестовых группах также были значительно лучше, чем в контрольных группах (диапазон 1,5–1,7 мм). Кровоточивость при зондировании была описана в одном исследовании и не показала значительных различий между группами.
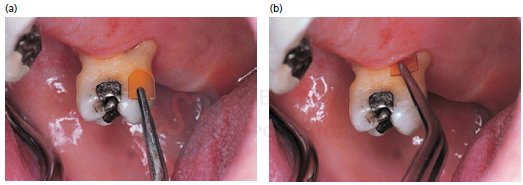
Введение чипа с хлоргексидином в пародонтальный карман
Сравнительная оценка методов лечения
Описанные выше результаты указывают на то, что несколько местных протоколов лечения противомикробными препаратами имеют потенциал для улучшения результатов нехирургической пародонтальной терапии, хотя в основном они связаны с изменениями глубины зондирования, но статистически значимые преимущества, как правило, были выявлены в менее чем половине доступных исследований. Кроме того, в большинстве исследований тестировалась одна форма локальной введения лекарств вместо сравнения различных форм терапии. Понятно, что основной интерес разработчиков и дистрибьюторов состоит в том, чтобы регистрировать и продвигать свой собственный продукт для максимально широкого использования, а не дифференцировать конкретные преимущества или недостатки различных препаратов. Эффективность коммерчески доступных систем локального введения в качестве дополнения к нехирургической механической терапии была протестирована только в двух исследованиях, включающих пациентов с персистирующими поражениями пародонта: Actisite, Dentomycin и Elyzol Dental Gel (Radvar et et al. 1996; Kinane & Radvar 1999); Atridox, ElyzolDental Gel и PerioChip (Salvi et al. 2002). В одном систематическом обзоре была проведена оценка литературных данных для определения относительного эффекта местной противоинфекционной лекарственной терапии с контролируемым высвобождением у пациентов с хроническим пародонтитом (Hanes & Purvis 2003). Мета-анализ, включающий 19 исследований, сравнивающих нехирургическую механическую терапию в сочетании с местными препаратами с замедленным высвобождением с только нехирургической механической терапией, подтвердил клинические преимущества миноциклинового геля, микроинкапсулированного миноциклина, доксициклинового геля и хлоргексидиновых чипов по сравнению с одной нехирургической механической терапией. Из-за разнородности исследований авторы не могли сделать каких-либо убедительных утверждений относительно превосходства одной системы над другой. В следующем систематическом обзоре рассматривались дополнительные преимущества различных локально используемых препаратов (Bonito et al. 2005).
К сожалению, данные были объединены из исследований, изучающих различные способы локальной внесения, включая ирригацию, пропитанные полоски и пасты. Тем не менее, статистически значимое среднее преимущество было замечено у четырех препаратов с точки зрения уменьшения потери клинического прикрепления — лучше всего у миноциклина, за которым следуют тетрациклин, хлоргексидин и метронидазол. Однако нельзя исключать, что различия, отмеченные между препаратами, в первую очередь отражают различия в способах применения и в исследуемых группах, а не в эффективности препарата. Некоторые исследования посвящены проблеме включения местной или системной антимикробной терапии в общую стратегию лечения. Поскольку непосредственных сравнений различных методов лечения пока еще мало, обоснованные алгоритмы принятия решений для выбора конкретных методов вмешательства для различных клинических ситуаций пока недоступны. Ключевой вопрос, требующий разъяснения, касается выбора местного или системного подхода к назначению всякий раз, когда показано использование антибиотика. Для пациентов с хроническим пародонтитом в двух исследованиях сообщалось о лучших результатах при проведении нехирургической механической обработки и местным применением метронидазола, по сравнению с дополнительным системным метронидазолом (Paquette et al. 1994; Noyanet al. 1997). Два исследования касались этого вопроса у пациентов с агрессивным пародонтитом. Не было отмечено существенных различий между системным назначением амоксициллин с клавулановой кислота или введением тетрациклиновых нитей в качестве дополнения к механической терапии (Bernimoulin et al. 1995). Совсем недавно та же группа исследователей сообщила, что нехирургическая механическая терапия в сочетании с амоксициллином и метронидазолом показали лучшие клинические результаты через 6 месяцев, чем хлоргексидиновые желатиновые чипы (Kaneret al. 2007a). Поскольку у пациентов, страдающих пародонтитом, могут быть выявлены различные схемы распространения таких микроорганизмов, как P. gingivalis (Mombelliet al. 1991a, b), местная терапия может быть менее успешной для пациентов, у которых широко распространены патогены, чем для пациентов, у которых их присутствие ограничено изолированными областями. Тем не менее, в настоящее время нет диагностического метода, который мог бы дать врачу подробную карту распределения патогенов пародонта при разумных затратах. Однако, даже если бы такая информация была доступна, исследование, оценивающее эффект местной антибиотикотерапии, назначаемой в области каждого зуба с культуральными признаками P. gingivalis или A.actinomycetem comitans, продемонстрировало ограничения данного подхода (Mombelli et al. 2002).
Местные антибиотики в клинической практике
Для успешного лечения заболеваний пародонта местные препараты должны обеспечивать терапевтические уровни антимикробных агентов в поддесневой области в течение нескольких дней. Клинические исследования показывают эффективность местной антибиотикотерапии в этих условиях. Имеющиеся данные свидетельствуют о том, что местное введение может быть наиболее полезным в борьбе с локализованным продолжающимся заболеванием у пациентов при стабильном состоянии в остальных участках. Таким образом, пациенты с несколькими участками, не реагирующими на лечение, могут получить наибольшую пользу от местной антимикробной терапии. Кроме того, потенциальное применение противомикробных препаратов, вводимых локально, включает лечение периимплантитов (Mombelli et al. 2001; Renvert et al. 2006). Местная антимикробная терапия повышает эффективность лечения пародонтита, предоставляя безоперационную альтернативу местного лечения с более сильными антибактериальными эффектами, чем нехирургическая механическая терапия. Однако анализ экономической эффективности показал, что системные противомикробные препараты более рентабельны, чем местные противомикробные препараты (Heasman et al. 2011). В последние годы ценность местной антибиотикотерапии снизилась, так как большинство адекватно протестированных препаратов было изъято с рынка. До настоящего времени ни одно местное антимикробное лечение не оказалось столь же или более эффективным, чем системный амоксициллин с метронидазолом.
Заключение
Антибиотики, назначаемые как системно, так и локально, могут усиливать эффект пародонтальной терапии. Чтобы ограничить развитие микробной резистентности к антибиотикам в целом и избежать риска нежелательных системных эффектов антибиотиков для человека, подвергаемого лечению, показано предупредительное, ограничительное отношение к применению антибиотиков. Чтобы ограничить их чрезмерное использование, рекомендуется не назначать антибиотики при наличии достаточных доказательств того, что только нехирургическая механическая обработка может решить проблему, и это относится к пародонтиту легкой и средней степени тяжести. Системные антибиотики, обеспечивающие дополнительное преимущество при нехирургической механической обработке в глубоких карманах, могут снизить потребность в дальнейшем хирургическом лечении. Системные антибиотики могут быть полезны также в качестве дополнения при лечении пациентов с неудовлетворительным ответом на механическую терапию. Локализованные участки, не отвечающие на терапию, и локализованные рецидивирующие воспаления можно лечить с помощью местных антибиотиков. Любой антимикробной терапии должна предшествовать тщательная механическая обработка (SRP). После устранения пародонтальной инфекции пациент должен быть включен в индивидуальную программу поддерживающей терапии для предотвращения повторного воспаления. В настоящее время наиболее доказанным способом использования антибиотиков в терапии пародонта является SRP с добавлением перорально амоксициллина и метронидазола. Можно рассматривать другие протоколы, включая SRP с метронидазолом или SRP с азитромицином, особенно у пациентов с хроническим пародонтитом.
Перевод материала «Antibiotics in Periodontal Therapy» Andrea Mombelli и David Herrera
1. Department of Periodontology, School of Dental Medicine, University of Geneva, Geneva, Switzerland
2. Faculty of Odontology, University of Complutense, Madrid, Spain
выполнен автором проекта «Современная пародонтология» Екатериной Чирковой. Все ссылки на литературные источники в оригинале статьи.
